نانو و آند باتری 2 -آند آلیاژی و معضل SEI

در این مقاله، احیای الکترولیت در آند که یک پدیده نانومقیاس است، توضیح داده میشود. تاثیرات منفی این پدیده، بر روی آندهای آلیاژی بیان شده و درباره چگونگی رفع این اثرات منفی با تهیه نانوساختارهای مناسب صحبت خواهد شد.
این مقاله شامل سرفصلهای زیر است:
1- تجزیه الکترولیت در آند
2- معضل SEI در سیلیکون
3- راه حل معضل SEI
4- جمعبندی و نتیجه گیری
1- تجزیه الکترولیت در آند
همانطور که میدانیم هر مادهای در یک محدوده پتانسیلی پایدار است و کمتر و بیشتر از این محدوده دچار فرآیند احیا یا اکسایش میشود. به همین دلیل است که میتوانیم آب را تجزیه (الکترولیز) کنیم و هیدروژن و اکسیژن تولید کنیم. این سلولها عکس سلولهای گالوانی (باتری) هستند و سلولهای الکترولیتی نامیده میشوند. در این سلولها برخلاف باتری، ما انرژی میدهیم تا یک واکنش را که از جنبه ترمودینامیکی مطلوب نیست، به اجبار انجام دهیم.
در هنگام شارژ باتری نیز درست مثل تجزیه آب، ما انرژی را از طریق شارژر به باتری میدهیم تا عکس واکنشی که در باتری انجام میشد صورت بگیرد و باتری به حالت قبل از تخلیه برگردد. الکترولیت آلی که در باتری یون لیتیومی استفاده میشود (همانند الکترولیز آب) در نتیجه انرژی ناشی از شارژر، دچار تغییر میشود. همانطور که بیان شد در یک باتری یون لیتیومی، در قطب منفی (آند گرافیتی) در حین شارژ احیای یون لیتیوم صورت میگیرد. با توجه به اینکه تمایل به احیای الکترولیت از نظر ترمودینامیکی بیشتر از یون لیتیوم است، بنابراین احیای الکترولیت بهجای احیای یون لیتیوم صورت میگیرد. این اتفاق باعث میشود بر روی سطح گرافیت یک لایه جامد ایجاد میشود. این لایه جامد اصطلاحا SEI مخفف (Solid Electrolyte Interface) نامیده میشود. ترکیب این لایه پیچیده و مخلوطی از چندین ماده شیمیایی است. شکل 1 شماتیک این لایه را نشان میدهد. همانطور که از روی شکل مشخص است، ترکیب این ماده دارای یون لیتیوم و کربن است؛ بنابراین تشکیل این لایه با کم شدن لیتیوم همراه است که موجب کاهش ظرفیت در اولین مرتبه شارژ میشود. این لایه ضخامتش همانطور که در شکل 1 نشان داده شده است، در محدوده نانومتری است. بررسی و تحقیق بر روی ترکیب SEI، مکانیزم تشکیل و ... یکی از مباحث مورد بررسی مقالات پژوهشی است.
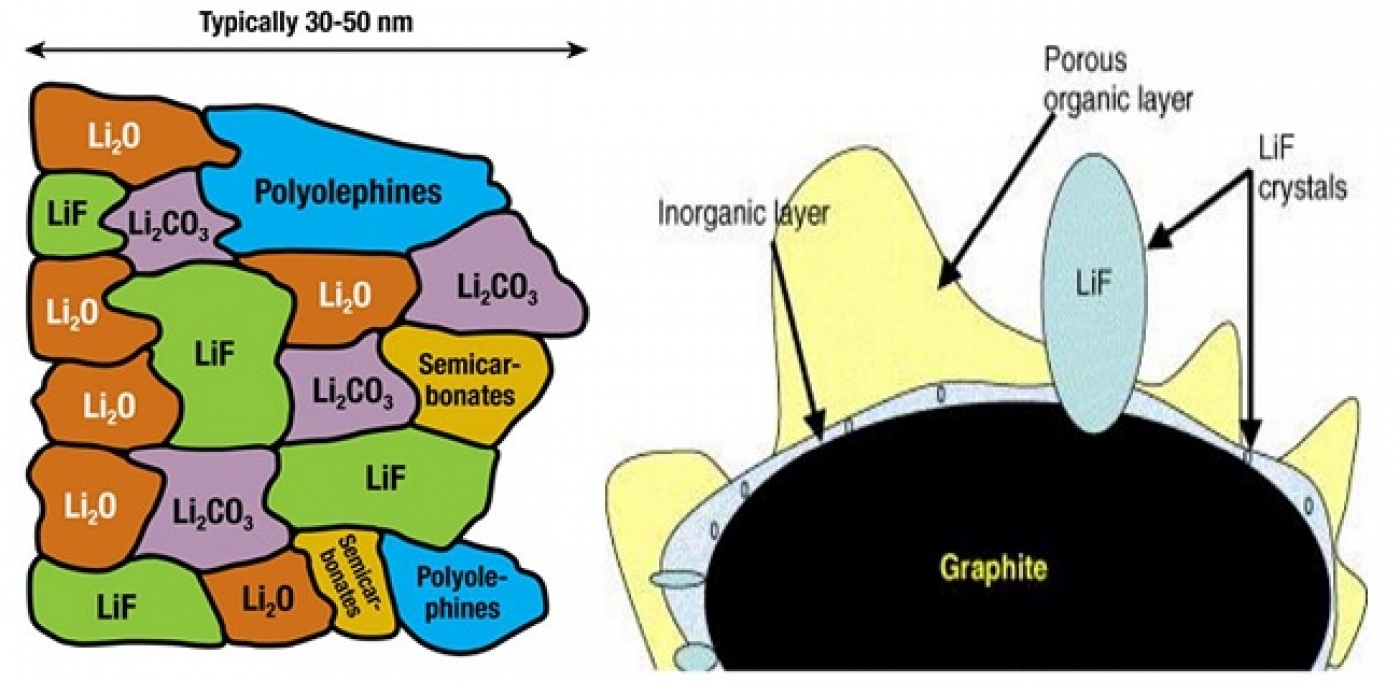
شکل 1- شماتیک تشکیل SEI و ترکیب این لایه
تشکیل لایه SEI، خودش ادامه واکنش احیای الکترولیت را محدود میکند. چون بهصورت یک مانع فیزیکی از رسیدن مولکولهای الکترولیت به سطح آند گرافیتی جلوگیری میکند. در واقع به صورت یک ممانعت سینیتیکی عمل میکند (همانند لایه پسیو اکسید آلومینیوم که از رسیدن اکسیژن به آلومینیوم زیرین جلوگیری میکند و از اکسید شدن بقیه آلومینیوم ممانعت به عمل میآورد). ازطرفی چون عایق الکترونی هست از رسیدن الکترون هم به الکترولیت ممانعت به عمل میآورد. بنابراین نه الکترون میتواند به سمت مولکول الکترولیت برسد و نه مولکول الکترولیت به سمت الکترون موجود در آند برود که هر دو موجب میشوند احیای الکترولیت دیگر صورت نگیرد و یک واکنش خود محدود شونده داشته باشیم. ولی خوشبختانه این لایه برای یون لیتیوم نفوذپذیر است و یون لیتیوم میتواند از آن عبور کند و به سطح آند برسد و الکترون بگیرد و احیا شود. این لایه چون مسافت نفوذ یون لیتیوم را برای رسیدن به آند زیاد میکند توان باتری را کاهش میدهد.
شکل 2 محدوده پایداری الکترولیت را در مقابل پتانسیل آندها و کاتدها نشان میدهد. اگر کاتدی دارای پتانسیل بالاتر از محدوده پایداری الکترولیت باشد، در کاتد و در هنگام شارژ، الکترولیت اکسید میشود و همینطور اگر آند دارای پتانسیل پایینتری از محدوده پایداری باشد، در آند و در هنگام شارژ الکترولیت احیا میشود. خوشبختانه همانطور که در شکل 2 مشاهده میشود، کاتدهای معمول مشکل ناپایداری الکترولیت را ندارند ولی در آند گرافیتی و سیلیکون ناپایداری وجود دارد و SEI تشکیل میشود.
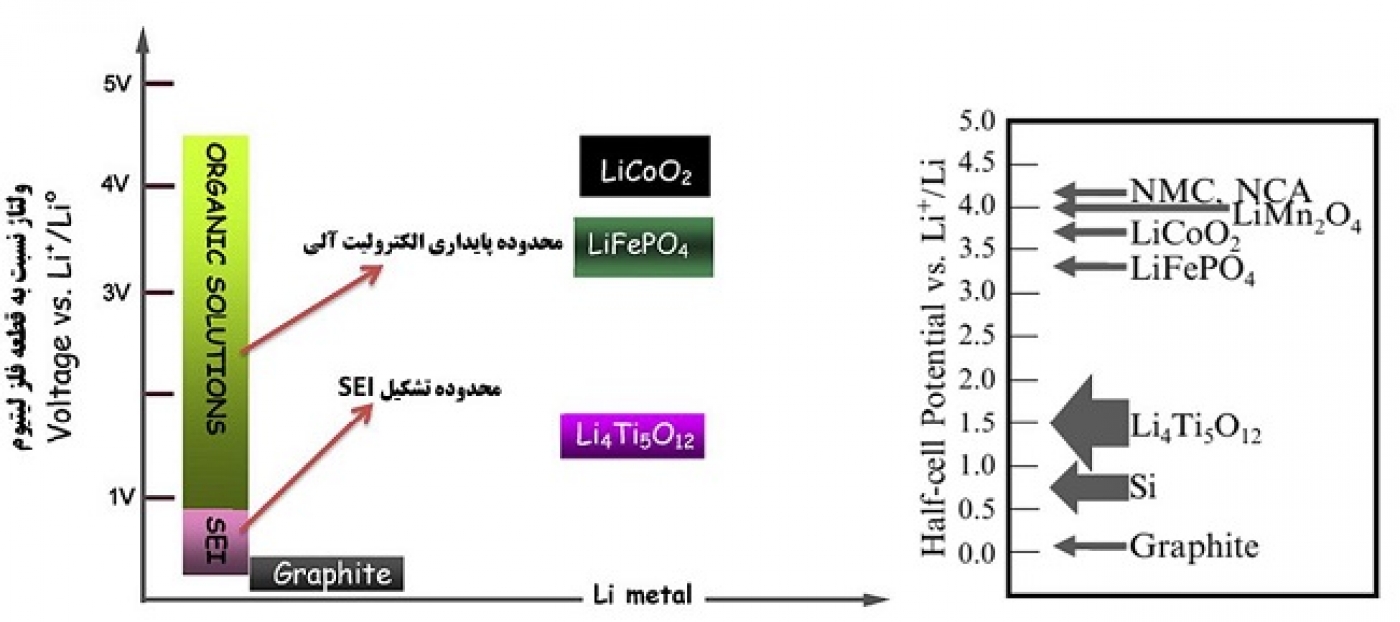
شکل 2- نمایش ولتاژ آندها و کاتدهای متداول و محدوده پتانسیل پایداری الکترولیت و محدوده پتانسیل تشکیل SEI
2- معضل SEI در سیلیکون
بهطور کلی برای آندهای کمتر از یک ولت نسبت به فلز لیتیوم، الکترولیت ناپایدار است و SEI تشکیل میشود. از اینرو در آند سیلیکونی که پتانسیل 0.3 تا 0.4 بالاتر از لیتیوم دارد نیز SEI تشکیل میشود. ولی چون متاسفانه سیلیکون تغییر حجم میدهد و خرد میشود، سطوح جدیدی از سیلیکون در معرض الکترولیت قرار میگیرد و بنابراین الکترون به الکترولیت رسیده و SEI جدید بر روی این سطوح تازه تشکیل میشود. به این جهت مدام از ظرفیت در طول سیکلهای کاری کاسته میشود. گفتن این نکته لازم است؛ چون تستها غالبا در مقابل فلز لیتیوم انجام میشود، در همه مقالات باتری ولتاژها نسبت به لیتیوم سنجیده میشود.
در نانومواد سیلیکونی چون فعالیت شیمیایی بیشتر است، حتی تشکیل SEI خیلی مستعدتر است. در مورد نانومواد درست است که خرد نمیشوند ولی تغییر حجم که میدهند. با توجه به شکل 3 این تغییر حجم باعث میشود که SEI به طور مداوم رشد کند و معایب رشد SEI مثل کاهش ظرفیت و توان و ... را شاهد باشیم.

شکل 3- نحوه رشد لایه SEI..
شکل 4 قسمت a علت رشد SEI را در نانومواد را بهتر نشان میدهد. اگر سطح مقطع یک نانوسیم (یا نانوذره و ...) را در حالت اولیه بدون لیتیوم، که در سمت چپ شکل نشان داده شده، داشته باشیم، در هنگام شارژ، چون سیلیکون لیتیومدار میشود حجمش زیاد میشود و بدلیل ناپایداری الکترولیت در همین هنگام یک لایه SEI بر روی نانوسیم تشکیل میشود. حالا در هنگام دشارژ، لیتیوم خارج شده و ذره کوچک میشود در حالیکه SEI کوچک نمیشود. این امر باعث میشود SEI تحت تنش خرد شود (یا حتی در مرحله دوم بزرگ شدن سیلیکون تحت لیتیومدار شدن، که در این هنگام چون دقیقا مرز بین SEI و ذره بر هم منطبق نیستند تنش ایجاد میشود و SEI خرد میشود). بنابراین در هنگام شارژ مجدد (لیتیومدار شدن)، دوباره یک لایه SEI جدید تشکیل میشود. تکرار همین چرخه، رشد مداوم SEI را در پی دارد و مشکلات ناشی از رشد آن را داریم، در حالیکه در گرافیت بدون تغییر حجم ناچیز آن، SEI رشد نمیکرد. لازم به ذکر است که آنچه درباره SEI و سیلیکون گفته شد برای دیگر آندهای آلیاژی هم برقرار است.
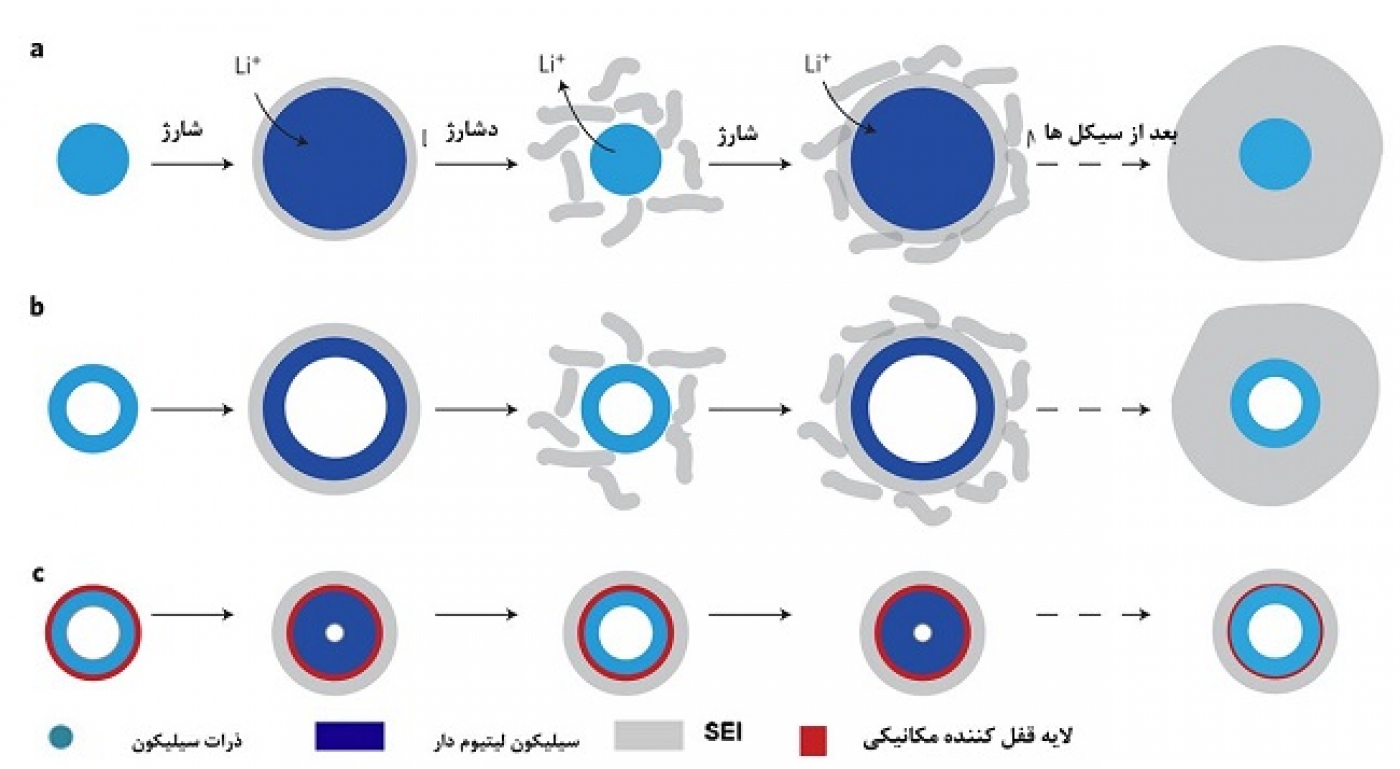
شکل 4- نمایش رشد SEI در شرایط مختلف.
3- راه حل معضل SEI
همانطور که در قسمت b مشاهده میشود، این مشکل برای نانولولههای سیلیکون هم وجود دارد ولی اگر بتوانیم از ابتدا به روشی از تماس سیلیکون با الکترولیت و از تغییر حجم آن در مجاورت الکترولیت جلوگیری کنیم، این مشکل حل میشود. برای این کار وو و همکارانش [1] همانند شکل 4 قسمت c از یک لایه قفلکننده مکانیکی استفاده کردند؛ این لایه که از جنس اکسید سیلیکون است، بدلیل استحکام مکانیکی، از تغییر حجم بیرونی نانولولهها جلوگیری میکند. بنابراین یک SEI پایدار و بدون تغییر حجم تشکیل میشود (یک لایه SEI پایدار همانند گرافیت). این لایه اکسیدی، هادی یون لیتیوم است بنابراین مشکلی برای انجام واکنش ایجاد نمیکند. فضای لازم برای تغییر حجم نیز از طریق دیواره داخلی نانولوله فراهم میشود. بنابراین مشکل خرد شدن هم ندارد. چون با بررسی مشخص شده که الکترولیت به داخل نانولوله نفوذ نمیکند، تماس بین الکترولیت و دیواره درونی نانولوله وجود ندارد. همه این مزایا موجب میشود طول عمر سیکلی و توان خوبی ارایه دهد. در شکل 5 (در شکل این نمونه با DWSiNT مشخص شده است) در قسمت a سیکلهای با دشارژ عمیق (deep discharge) این نمونه نشان داده شده است. همیشه در دشارژ عمیق طول عمر سیکلی سریعتر کاهش مییابد با این همه مشاهده میشود که بعد از 900 سیکل هنوز نمونه تهیه شده ظرفیت خوبی دارد ولی نمونههای نانولوله و نانوسیم معمولی ظرفیتشان سریع افت میکند.( منحنی قسمت b که در سرعت نسبتا بالای 2C 0.5 ساعته دشارژ می شود) برای نمونه رسم شده، نشان میدهد که ظرفیت حتی بعد از این نرخ C نسبتا بالا حتی در تا 6000 سیکل باز ظرفیت خود را حفظ میکند. مباحث مربوط به این نمونه زیاد است، همچون مورفولوژی SEI درهر سه نمونه و ... که جهت اختصار در پاورپوینت ارایه آمده است.
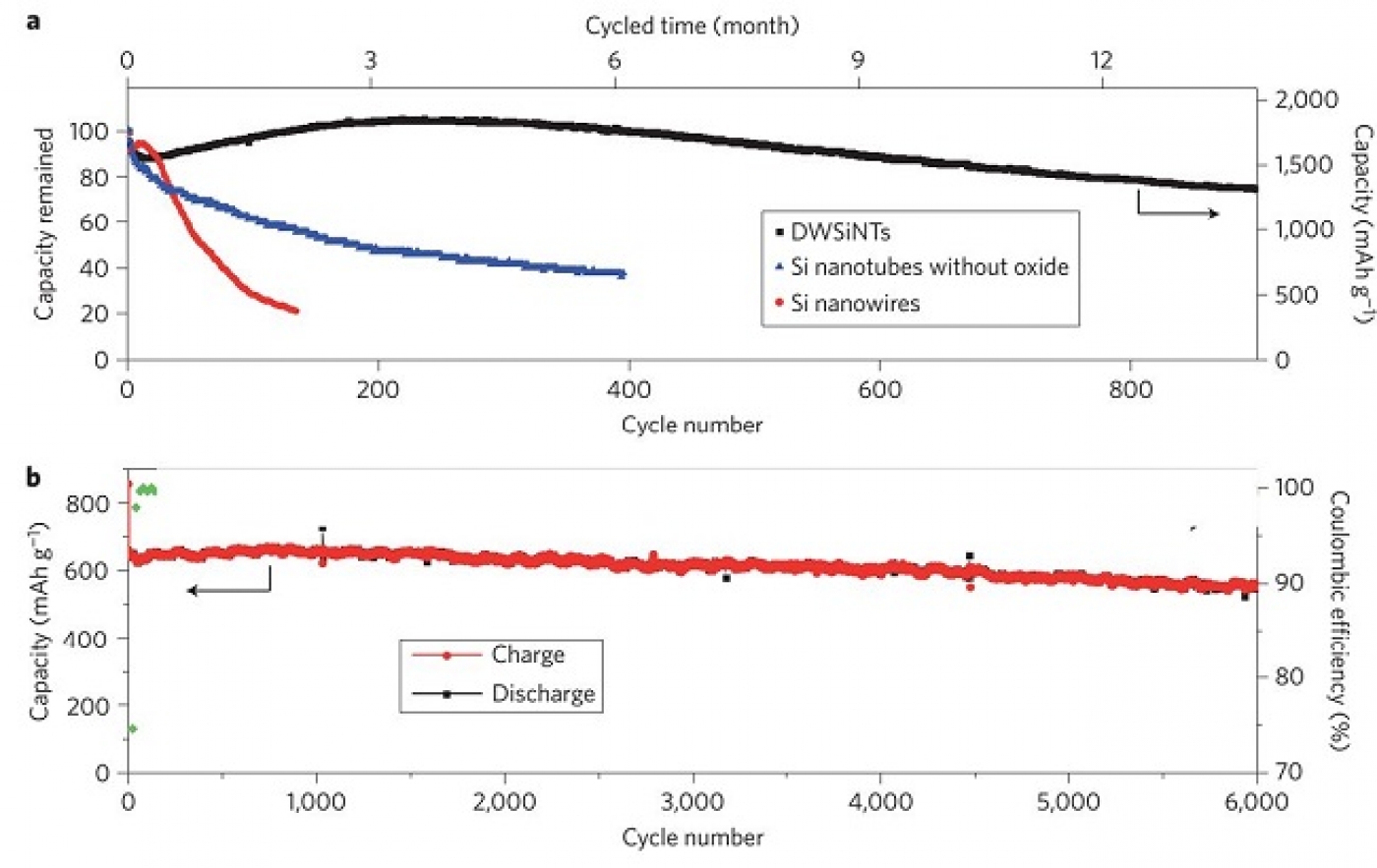
شکل5- a مقایسه بین طول عمر سیکلی به ترتیب مشکی،آبی وقرمز برای نمونه با پوشش اکسید، نانولوله بدون اکسید و نانوسیم بدون اکسید، b طول عمر سیکلی طولانی بالای نمونه دارای پوشش اکسیدی
در نمونه دیگر [2] یک ساختار هسته-پوسته تهیه شده است، همانطور که در شکل 6-c دیده میشود یک پوشش کربنی استفاده شده است که نانوذره سیلیکونی درون این پوشش کربنی قرار دارد. ضخامت پوشش کربنی در محدوده 10 نانومتر و شامل ذرات سیلیکون 100 نانومتری است. پوسته کربنی با چنان فضای کافی تهیه شده است که تغییر حجم نانوذره سیلیکونی، همانگونه که شکل c نشان میدهد، به راحتی صورت گیرد. از طرفی نانوذره سیلیکونی از یک نقطه به پوسته کربنی متصل است، بنابراین انتقالهای الکترونی و یونی به آن صورت میگیرد. چون کربن در مجاورت الکترولیت است و نه سیلیکون، بنابراین همانند گرافیت یک SEI پایدار بدون خردشدگی تشکیل میشود چون تغییر حجم سیلیکون به کربن و از کربن به SEI منتقل نمیشود لذا مشابه نمونه شکل 3 طول عمر سیکلی بالایی دارد.

شکل6-a- نمایش الکترود ساخته شده از نانوذرات سیلیکون. b- نمایش الکترود ساخته شده از نانوذرات سیلیکون با پوشش کربنی و ساختاری توخالی. c- ساختار هسته- پوسته توخالی استفاده شده در b، سیلیکون درون کربن تو خالی قرار دارد و نمایش تغییر حجم آن در هنگام لیتیومدار شدن مشاهده میشود.
اگر نانوذرات سیلیکون را به صورت معمولی به کار میبردیم علاوهبر مشکل SEI، همانگونه که در مقاله پیشین هم دیدیم و شکل a ، نشان میدهد که بین نانوذرات سیلیکون فضای خالی برای تغییر حجم وجود ندارد بنابراین بین ذرات وقتی تغییر حجم میدهند تنش ایجاد میشود ولی وقتی این ساختار توخالی (شکل b) را استفاده کنیم دیگر تنش در میان ذرات وجود ندارد.
این آند مزیتهای دیگری علاوه بر رفع مشکل SEI، نسبت به نمونه شکل 3 دارد. یک مزیت ناشی از برتریهای سنتز نانوذره نسبت به نانولوله، و حسن مهمتر اینکه استفاده از نانوذرات در مقایسه با نانوسیمها، با روش دوغابی (Slurry) که روش مرسوم تهیه الکترودها در باتری است به خوبی سازگار است.
تا بهحال درباره دو نوع آند گرافیت و آندهای آلیاژی (سیلیکون) صحبت شد. در این دو مقاله اخیر بحث مختصری درباره سیلیکون شد که اصول کلی آن برای دیگر آندهای آلیاژی هم صادق است. درباره این نوع آندها تحقیقات بسیار وسیعی صورت گرفته و شاید بتوان گفت درباره هیچ یک از اجزای باتری همانند آند و آن هم درباره آندهای آلیاژی مقاله خصوصا با ایمپکت بالا نیست. بنابراین آنچه در اینجا گفته شد بخش ناچیزی از این مطالب است ولی سعی شده است مطالبی درباره آندهای سیلیکونی گفته شود تا مقالات جنبه آموزشی داشته باشند، مشکلات آندها و روشهای حل آن با نانو بیان شود و یک دید مناسب در حل این مشکلات داده شود.
4- جمعبندی و نتیجه گیری
در این مقاله درباره SEI که یکی از مهمترین مباحث اغلب آندها و بعضی کاتدهای ولتاژ بالاست صحبت شد. در مقاله قبلی درباره مشکل خردشدگی آندهای آلیاژی بحث شده بود در حالیکه در این مقاله درباره مشکل دوم که ناشی از رشد مداوم SEI است، صحبت شد. مشخص شد که برای داشتن طول عمر سیکلی مناسب باید براین مشکل غلبه کرد. با توجه به مثالهای بیان شده باید با استفاده از طراحی مناسب در مقیاس نانو شرایطی را فراهم کرد که علاوه بر فراهم کردن تغییر حجم آزاد سیلیکون، این تغییر حجم در تماس با الکترولیت رخ ندهد.
منابـــع و مراجــــع
۱ - Wu, Hui, et al. "Stable cycling of double-walled silicon nanotube battery anodes through solid-electrolyte interphase control." Nature nanotechnology 7.5 (2012): 310-315.
۲ - Liu, Nian, et al. "A yolk-shell design for stabilizedscalable Li-ion battery alloy anodes." Nano letters 12.6 (2012): 3315-3321.
۳ - Pinson, Matthew B.,Martin Z. Bazant. "Theory of SEI formation in rechargeable batteries: capacity fade, accelerated aginglifetime prediction." Journal of The Electrochemical Society 160.2 (2013): A243-A250.
۴ - Nie, Mengyun. Anode solid electrolyte interphase (SEI) of lithium ion battery characterized by microscopyspectroscopy. Diss. University of Rhode Island, 2014.
۵ - Yazami, Rachid, ed. Nanomaterials for Lithium-ion Batteries: FundamentalsApplications. Crc Press, 2013.
۶ - Yoshio, M.; Wang, H.; Fukuda, K.; Umeno, T.; Dimov, N.; Ogumi, Z. J.Electrochem. Soc.2002, 149, A1598−A1603
۷ - Dimov, N.; Kugino, S.; Yoshio, M.Electrochim. Acta2003, 48, 1579−1587
۸ - Osaka, Tetsuya,Zempachi Ogumi, eds. Nanoscale Technology for Advanced Lithium Batteries. Springer, 2014.

