باتری یون لیتیومی-معرفی مکانیزم و افت پتانسیلها

در حال حاضر، باتری یون لیتیوم بدلیل مشخصات عالی، برجستهترین باتری از جنبه کاربرد و تحقیق و توسعه است. در این مقاله باتری یون لیتیومی معرفی و مزایای آن و مکانیزم عملکرد آن شرح داده میشود. ارتباط ویژگیهای بیرونی با واکنشها و انتقالهای میکروسکوپی، و مشکل رشد دندریتی برای باتری یون لیتیومی بیان میشود. بهعلاوه این مقاله واکنشهای دقیق و آنچه در شارژ و دشارژ اتفاق میافتد را بیان میکند.
این مقاله شامل سرفصلهای زیر است:
1. معرفی باتری یون لیتیومی
2. ارتباط مشخصهها با اتفاقات میکروسکوپی
3. نانو و افت پتانسیلهای سنیتیکی
4. جمعبندی و نتیجهگیری
1. معرفی باتری یون لیتیومی
لیتیوم طبق جدول پتانسیل الکتروشیمیایی (جدول 1)، منفیترین پتانسیل احیایی را دارد. به همین دلیل میتواند به عنوان یک آند با مناسبترین ولتاژ برای باتری مطرح باشد.
جدول 1- سری پتانسیلهای الکتروشیمیایی بر مبنای واکنش احیایی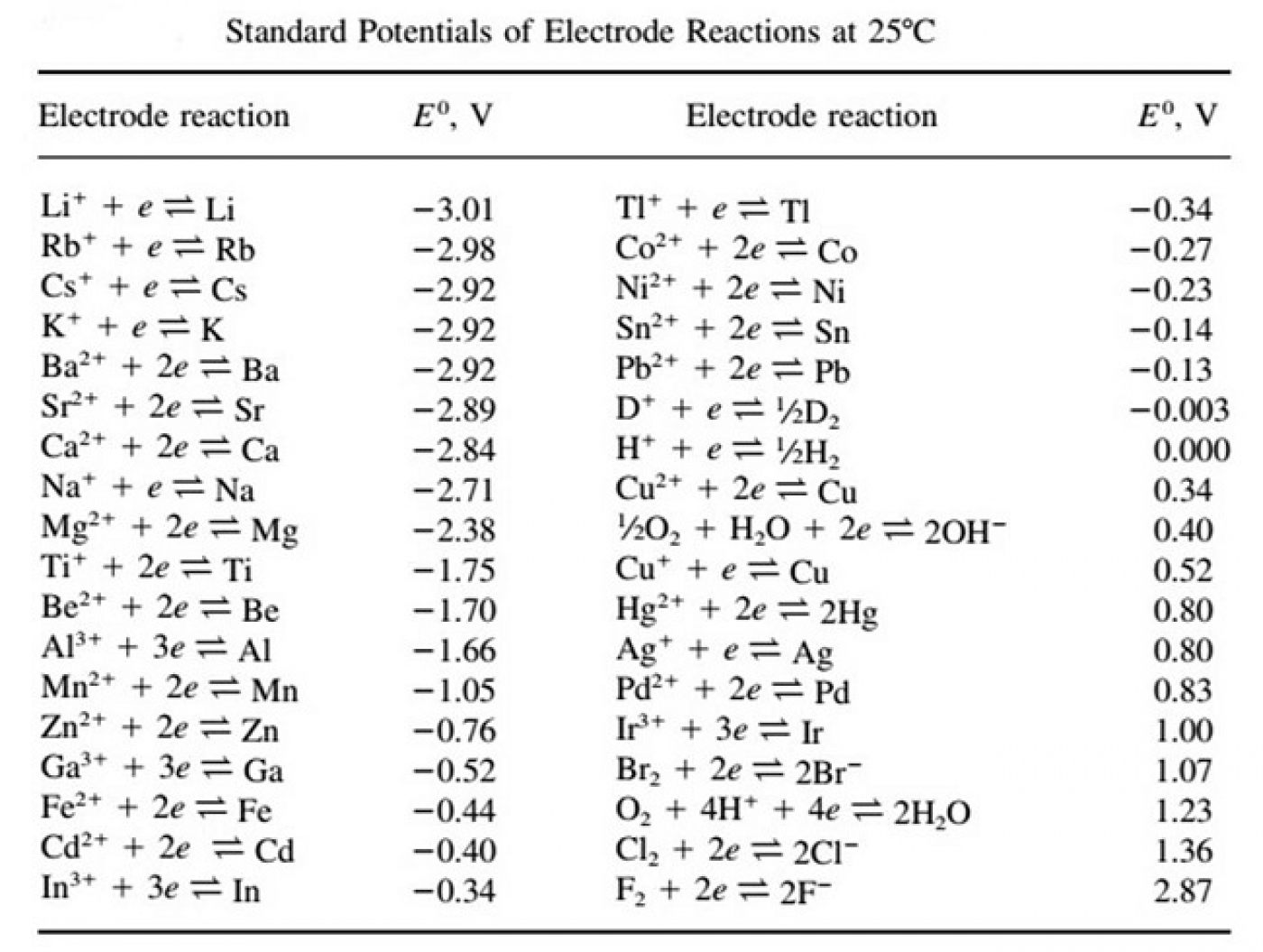
همچنین لیتیوم بدلیل جرم مولی پایین (سبکی)، ظرفیت بالایی را فراهم میکند. برای مقایسه؛ فلز روی دارای ظرفیت 0.82Ah/g و سرب دارای ظرفیت 0.26Ah/g است، در حالیکه لیتیوم دارای ظرفیت 3860mAh/g) 3.86Ah/g) است. روی همرفته، ظرفیت و ولتاژ بالای لیتیوم، میتواند چگالی انرژی بالایی را در باتری فراهم کند. همچنین لیتیوم شعاع کوچکی دارد که موجب میشود سرعت انتقال یونی بالایی داشته باشد و توان خوبی را برای باتری ارایه دهد. اما لیتیوم واکنشپذیری بالایی دارد. لیتیوم چون یک فلز قلیایی است با آب بهشدت واکنش میدهد بنابراین نمیتوان از محلول آبی به عنوان الکترولیت استفاده کرد. در باتریهای اولیه (غیرقابل شارژ) با جایگزینی الکترولیت آلی به جای آب، این مشکل حل میشود. الکترولیت آلی از یک حلال آلی مانند اتیلن کربنات تشکیل شده که به آن یک نمک از لیتیوم مثل LiPF6 اضافه میشود تا رسانش یونی لازم را فراهم کند اگر چه رسانش یونی این باتری کمتر از محلول آبی است ولی مشکل واکنشپذیری را حل میکند. اما استفاده از فلز لیتیوم در باتریهای ثانویه (قابل شارژ) امکانپذیر نیست. در حین دشارژ، اتم لیتیوم در قطب منفی اکسید میشود (تبدیل به یون)، یون لیتیوم به قطب مثبت رفته و واکنش احیایی صورت میگیرد. خب تا اینجا مشکلی نیست، اما در حین شارژ باتری، باید تمامی واکنشها برعکس شود (همانطور که در مقالات اولیه بیان شد، در شارژ جای آند و کاتد عکس میشود ولی قطب مثبت و منفی همواره ثابت است)؛ یعنی یون لیتیوم به سمت قطب منفی (همان محل فلز لیتیوم) بیاید و احیا شود (یون تبدیل به اتم شود) و بعد روی قطب منفی رسوب کند. به دلایلی که در حال حاضر لازم به ذکر نیست لیتیوم به صورت رسوب یکنواخت و مسطحی رشد نمیکند (در بعضی مناطق خیلی سریعتر رشد میکند) که اصطلاحا رشد دندریتی گویند. این نوع رشد در شکل 1 نشان داده شده است. علاقهمندان برای آشنایی با رشد دندریتی میتوانند به کتابهای مهندسی مواد مراجعه کنند ولی برای مباحث ما همین مقدار کفایت میکند. چون فاصله بین دو الکترود زیاد نیست (چون وقتی فاصله زیاد باشد مقاومت الکتریکی مربوط به رسانش یونی زیاد و باتری غیر مفید میشود) رشد لیتیوم ادامه مییابد و به قطب مثبت میرسد و منجر به اتصال کوتاه باتری میشود. در نتیجه گرمای بالایی تولید شده در حالیکه دیگر جریان الکتریکی تولید نمیشود. گرمای زیاد منجر به وقوع یک سری واکنشهای زنجیرهای میشود که بدلیل واکنشپذیری بالای فلز لیتیوم حتی احتمال انفجار وجود دارد.
شکل 1- نمایش رشد دندریتی برای لیتیوم
وجود این مشکلات و از طرفی، جذابیت الکتروشیمیایی فلز لیتیوم، منجر به این شده تا تحقیقاتی برای جایگزینی فلز لیتیوم ولی بهرهبرداری از مزایای واکنش لیتیوم صورت گیرد. لذا برای اولین بار شرکت سونی باتریهایی را تولید کرد که در آنها به جای فلز لیتیوم، از گرافیت (که مشکل رشد دندریتی ندارد) به عنوان آند استفاده میشود. در این باتری واکنش اکسیداسیونی مربوط به لیتیوم، در گرافیت رخ میدهد. بدین شکل که در حین شارژ، یون لیتیوم احیا میشود و بهصورت اتم لیتیوم در بین صفحات گرافیت ذخیره میشود. در حالیکه در زمان دشارژ، اتم لیتیوم موجود در گرافیت، به شکل یون درآمده و به سمت کاتد حرکت میکند و در آنجا واکنش احیا (البته احیای یک عنصر واسطه، نه یون لیتیوم) رخ میدهد. تمامی واکنشها همراه با واکنش کلی باتری به خوبی در شکلهای 2 و 3 نمایش داده شده است. در شکل 2، M یکی از عناصر واسطه همانند کبالت، نیکل، منگنز و یا ترکیبی از اینهاست و در کاتد، تغییر عدد اکسایش یکی از این عناصر صورت میگیرد. کاتد باتریهای تجاری از جنس LiCoO2 است که به اختصار LCO نامیده میشود. چون در این نوع آند و کاتد بیان شده، به ترتیب، اتم و یون لیتیوم ذخیره میشوند به این نوع الکترودها درجی (Intercalation) گویند.
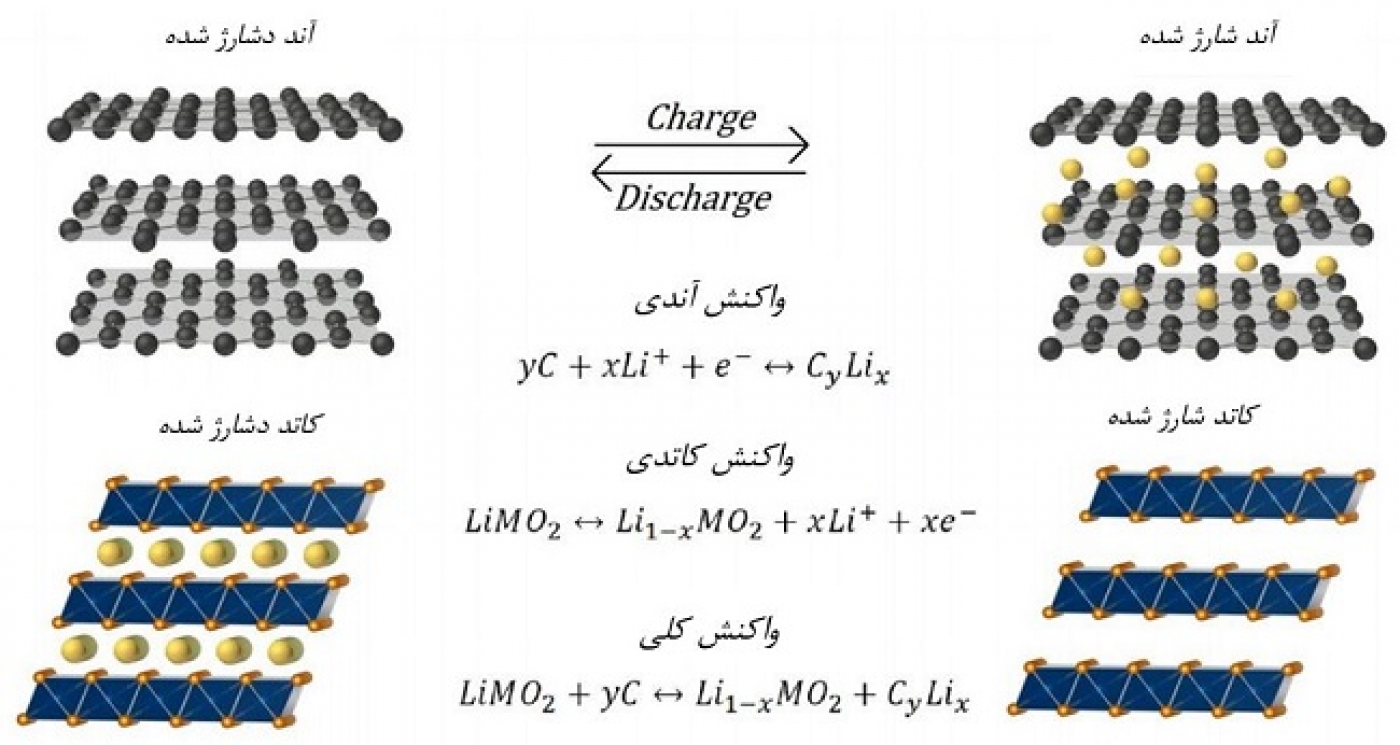
شکل 2- نمایش واکنشها و عملکرد باتری یون لیتیومی
برای ایجاد جریان در یک باتری، باید کل چرخه انتقال یونها، الکترونها و واکنشها طی شود. در حالت دشارژ ابتدا باید در آند (گرافیت) اتم لیتیوم موجود در لایههای گرافیت از آن خارج شده و تبدیل به یون لیتیوم شود، سپس یون درون الکترولیت، و الکترون آزاد شده از واکنش، درون مدار بیرونی حرکت کند. یون لیتیوم از طریق الکترولیت به کاتد میرسد و در درون ساختار کاتد قرار میگیرد و الکترون هم از طریق مدار بیرونی وارد کاتد شده و کاتد را احیا میکند. در زمان شارژ کلیه واکنشها عکس میشوند.

شکل 3- نمایش یک باتری یون لیتیومی تجاری همراه با واکنشها
به دلیل حضور یون لیتیوم در واکنشها به این نوع باتری، یون لیتیومی LIB)Lithium Ion Battery) گفته میشود. در حالیکه به باتریهای اولیه، که از خود فلز لیتیوم به عنوان آند استفاده میکنند، باتری لیتیومی گویند. در باتری یون لیتیومی چون هنوز هم واکنش اکسایش اتم لیتیوم رخ میدهد (ولی این بار در آند گرافیتی به جای قطعه فلز لیتیوم)، دارای ولتاژی برابر 0.05 ولت تا 0.1 ولت بیشتر از قطعه فلز لیتیوم است. ولی ظرفیت گرافیت، مقدار 360mAh/g است که تقریبا 0.1 ظرفیت فلز لیتیوم است. ظرفیت به این دلیل پایین است که گرافیت نمیتواند به مقدار زیادی لیتیوم در خود ذخیره کند. چون ظرفیت دقیقا به تعداد لیتیومهای قابل ذخیره بستگی دارد ولی بدلیل ولتاژ خیلی نزدیک به قطعه فلز لیتیوم، چگالی انرژی بالایی را ارایه میدهد. به طوریکه باتری یون لیتیومی دارای ولتاژ سه برابر ولتاژ باتری نیکل متال هیدرید است و دارای چگالی انرژی چهار برابر باتری سرب اسید است.
محاسن بالا موجب شده تا باتری یون لیتیومی به عنوان یکی از باتریهای پرکاربرد مطرح باشد که به طور مداوم بر کاربرد آن افزوده شود و عمده تحقیقات و سرمایهگذاریها بر روی آن متمرکز است. شکل 4 که مربوط به چندین سال پیش است، کاربرد باتریهای لیتیومی را نشان میدهد که سهم قابل توجهی است.

شکل 4 - نمایش یک باتری لیتیومی تجاری همراه با واکنشها
با توجه به این، اهمیت اکثر مباحث مربوط به نانوفناوری این نوع باتریها و باتریهای نسل آینده مثل باتریهای لیتیوم-سولفور، لیتیوم-هوا، سدیمی و ... مرتبط است. با این اوصاف باتریهای نسل قدیمیتر که مطالب نانوفناوری کمتری دارند مثل باتریهای نیکل متال هیدرید و سرب اسید به صورت جداگانه بحث نمیشوند فقط اگر مطالبی موجود باشد در مقالات متفرقه بیان خواهد شد. همچنین باتریهای اولیه از جمله باتری لیتیومی بدلیل یک بار مصرف بودن، خیلی مورد پژوهش خصوصا در حوزه نانو نیستند. یک نکته قابل ذکر نیز این که در خیلی از نوشتجات علمی به باتری یون لیتیومی به اختصار لیتیومی هم گفته میشود.
دو نکته مهم وجود دارد که متاسفانه حتی، در خیلی از مقالات ISI هم دقت نشده است. یک اینکه در گرافیت یون لیتیوم ذخیره نمیشود بلکه اتم لیتیوم ذخیره میشود و در کاتد این یون لیتیوم نیست که احیا میشود بلکه یون لیتیوم به کاتد رفته و در آنجا نه یون لیتیوم بلکه یک عنصر دیگر، مثلا در کاتدهای متداول که از جنس LiCoO2 است کبالت احیا میشود. چون اگر لیتیوم در کاتد احیا بشود ولتاژ باتری صفر میشود (طبق جمع ترمودینامیکی دو واکنش عکس هم، و اعمال قانون نرست).
2. ارتباط مشخصهها با اتفاقات میکروسکوپی
هدف اصلی از تحقیقات در باتری یون لیتیومی و دیگر باتریها بهبود ویژگیهایی از باتری مانند انرژی، توان، ظرفیت، ایمنی، پایداری، ارزانی، طول عمر سیکلی و مانند آن است. این ویژگیها دقیقا به مکانیزم واکنشها و انتقالهای یونی و الکترونی باتری لیتیومی بستگی دارد. مثلا برای اینکه از ظرفیت باتری استفاده کنیم باید چرخه کامل باتری طی شود یا مقدار توان به سرعت نفوذ یونهای لیتیوم مرتبط است. به بیان دیگر، آنچه از ویژگیهای بیرونی باتری مشاهده میکنیم به رفتار یون لیتیوم و الکترونها در الکترود و الکترولیت مربوط است؛ به طور مثال ظرفیت یک آند با تعداد اتم لیتیوم قابل ذخیره در زمان شارژ و آزاد شدن در حین دشارژ سنجیده میشود یا پلاریزاسیون غلظتی که یکی از عوامل افت ولتاژ در باتری است، از سرعت کند نفوذ یون در الکترودها نتیجه میشود.
گفتیم که برای ایجاد جریان باید چرخه به طور کامل طی شود. حالا اگر جریانی که از باتری میگیریم بالا باشد قبل از اینکه یونهای لیتیوم فرصت کنند ساختار کاتد را از انتها پر کنند، بدلیل سرعت بالا در همان مراحل ابتدایی کاتد را پر میکنند و مانعی برای قرارگیری تمام یونهای لیتیوم در کاتد میشوند که موجب میشود این یونهای جدید نتوانند در ظرفیت شرکت کنند و این یکی از دلایل کاهش ظرفیت در مقابل افزایش جریان است که در مقالات قبل توضیح داده شد.
در باتریهای لیتیومی نیاز است که الکترودها علاوه بر رسانایی الکتریکی، توانایی ذخیره و هدایت یونها را هم داشته باشند. اما به طور مثال در باتری دنیل نیازی به هدایت یونی الکترودها نیست. این قضیه انتخابهای ما را برای الکترودها محدود میکند چون علاوه بر لحاظ کردن ولتاژ و ظرفیت بالا، باید رسانایی یونی خوبی هم موجود باشد. نانوساختارها بدلیل اینکه مسافت نفوذ را کاهش میدهند و همچنین نسبت سطح به حجم بالا، میتوانند راه حلی برای بهبود رسانایی یونی باشند که در بخشهای آتی به این موضوع پرداخته میشود.
توان یک باتری مستقیما به سرعت انتقالهای یونی و الکترونی و سرعت واکنش اکسیداسیونی بستگی دارد. در باتری غالبا واکنشهای شیمیایی با سرعت مناسبی رخ میدهد، بنابراین محدودکننده جریان نیست. در باتریهای با الکترولیت مایع (غالب باتریها الکترولیت مایع دارند) بدلیل ماهیت مایع، رسانایی یونی بالاست لذا آن هم محدودکننده جریان باتری نیست اما الکترودها به دلیل جامد بودن (فضای فشردهتر) انتقال یونی مناسبی ندارند؛ به علاوه الکترودها، هادیهای الکترونی خوبی هم نیستند، بنابراین الکترودها محدودکننده جریان (یا توان) یک باتری هستند. در واقع یکی از علل کاهش انرژی در اثر افزایش توان، افتهای مقاومتی ناشی از انتقال الکترونها و یونهاست. لذا باید تا حد امکان این رسانایی یونی و الکترونی را افزایش داد تا توان مناسبی از باتری دریافت گردد. هرچه ابعاد ذرات ریزتر باشد، فاصله نفوذ یونها و الکترونها کمتر شده، از اینرو رسانایی یونی و الکترونی بیشتر میشود. برای مثال در باتری لیتیومی وقتی کاتد مسیر مناسبی برای حرکت یونهای لیتیوم فراهم نکند، سرعت حرکت یونهای لیتیوم پایین خواهد بود و لذا جریان کم خواهد بود. با نانوساختار کردن چون مسافت نفوذ برای یونها کمتر میشود میتوان توان را بالا برد (یکی از حوزههای دیگر کاربرد فناوری نانو).
3. نانو و افت پتانسیلهای سنیتیکی
بهطور کلی برای هر باتری صرف نظر از نوع آن، همواره سه نوع افت پتانسیل وجود دارد. این افت پتانسیلها دلایل سینتیکی دارند و اصطلاحا به آنها اورپتانسیل گفته میشود. این سه نوع افت پتانسیل در شکل 6 نمایش داده شده است. همانطور که مشاهده میشود هر کدام از این افتها در محدوده جریان خاصی اهمیت بیشتری دارند و غالب میشوند. این افتها در باتری و پیلهای سوختی تاثیر فراوانی بر کاهش عملکرد دارند. یکی از افتها ناشی از انرژی فعالسازی لازم برای واکنشهاست که به آن پلاریزاسیون فعالسازی (Activation polarization) گویند. این نوع اورپتانسیل از معادله تافل تبعیت میکند که رابطه لگاریتمی بین جریان و افت پتانسیل وجود دارد. این نوع افت پتانسیل، در جریانهای کم خود را نشان میدهد. بهدلیل سرعت بالای واکنش یون لیتیوم، این نوع از افت پتانسیل نقش خیلی عمدهای در باتری یون لیتیومی ندارد ولی در باتریهای دیگری مثل لیتیوم-هوا یکی از مشکلات همین افت پتانسیل است که استفاده از کاتالیست را برای کاهش انرژی فعالسازی اجتنابناپذیر میکند. در حوزه این کاتالیستها فناوری نانو میتواند وارد شود.

شکل 5- نمایش افت پتانسیلهای سنیتیکی
نوع دیگری از افت پتانسیل که در باتری رخ میدهد ناشی از مقاومت الکترودها در انتقال گونههای باردار است (الکترونها و یونها) و اصطلاحا پلاریزاسیون اهمی (Ohmic polarization) نامیده میشود. چون الکترولیت یک رسانای ایدهآل یونی نیست و الکترودها برای رسانش الکترون ایدهآل نیستند و همچنین مقاومت اتصالات گوناگونی که وجود دارد همگی، موجب میشود که یک افت پتانسیل (که از قانون اهم تبعیت میکند داشته باشیم (همان مقاومت داخلی). همان طور که شکل 5 دلالت دارد، این افت پتانسیل در نواحی میانی جریان خود را نشان میدهد. در باتریهای لیتیومی با الکترولیت مایع این افت پتانسیل عامل غالب نیست. ولی در باتریهای با الکترولیت جامد که امروزه در باتریهای موبایل استفاده میشود رسانش یونی الکترولیت جامد ضعیف است که باعث میشود توان و ولتاژ افت کند ولی تحقیقات نشان داده است که اضافه کردن نانوذرات به الکترولیتهای جامد رسانش یونی بهبود قابل ملاحظهای مییابد.
افت پتانسیل سوم با نام پلاریزاسیون غلظتی (Concentration polarization) که برای باتریهای یون لیتیومی مهم است ناشی از گرادیان (اختلاف) غلظت یونی است. این اختلاف از کند بودن سرعت نفوذ یون لیتیوم در الکترودهای جامد ناشی میشود. واکنش اکسیداسیونی بهسرعت صورت میگیرد ولی چون یونها به دلیل ساختار فشرده الکترودها، خصوصا کاتد، به همان سرعتی که واکنشها انجام میشود به محل واکنش نمیرسند، یک اختلاف غلظت یونی ایجاد میشود که چون یونها باردارند، تولید یک ولتاژ میکنند که از ولتاژ باتری کسر میشود. این نوع افت پتانسیل در جریانهای بالا رخ میدهد و رابطه لگاریتمی با جریان دارد. این افت ولتاژ چون به نفوذ بستگی دارد، کم کردن مسیر لازم برای نفوذ، میتواند در کاهش افت پتانسیل موثر باشد لذا نانوفناوری در این حوزه میتواند موثر باشد.
شکل 6 ولتاژ و توان نرمالیزه شده را بر اساس جریان نرمالیزه شده، همراه با علل کاهش ولتاژ که در بالا توضیح داده شد، نشان میدهد. همانطور که مشاهده میشود ماکزیمم توان در جریانهای بالا رخ میدهد و این همان تناظر یک به یک بین توان و جریان را که قبلا بیان کردیم به نوعی دیگر ثابت میکند. با استفاده از مواد دارای ساختار کریستالوگرافی مناسبتر و همینطور تنظیم ریزساختار (مانند نانو ابعاد کردن) میتوان هم مقدار توان را افزایش داد و هم موقعیت آن را در شکل بیشتر به سمت چپ برد. چون نانو اورپتانسیلها را کم میکند و در الکترودهای بهرهمند از نانو، میتوان جریان را افزایش داد بدون اینکه ظرفیت به مقدار قابل ملاحظهای کاهش یابد.
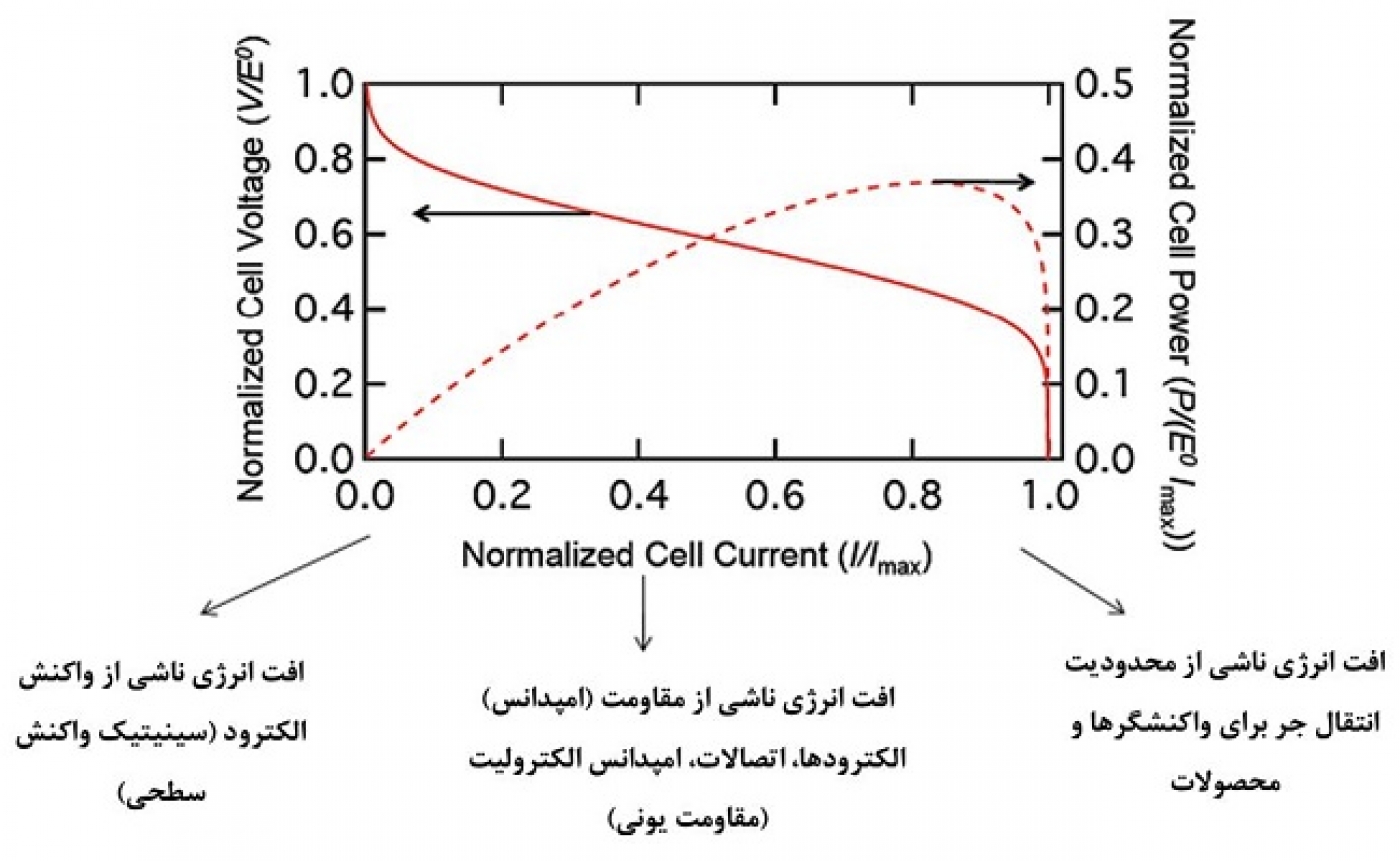
شکل 6- نمایش دیگری از توان و ولتاژ نرمالیزه شده باتری بر اساس جریان نرمالیزه شده
4. جمعبندی و نتیجهگیری
در این مقاله با باتری یون لیتیومی آشنا شدیم و مزایای نانو نیز در خلال مباحث گفته شد. مشخص شد که آنچه به صورت میکروسکوپی رخ میدهد مثل سرعت انتقالها و واکنشها بر روی مشخصههایی از باتری که در بیرون میبینیم مثل توان و ... اثرگذار است. در حین بیان این مطالب، معلوم شد که نانو به طور موثری بر روی این مکانیزمهای درونی موثر است و موجب میشود مشخصههای باتری بهبود یابد. در آخر، انواع اورپتانسیلها و اهمیت آنها بر روی باتری یون لیتیومی بیان شد و تاثیر نانو در کاهش این اورپتانسیلها هم بهصورت خلاصه گفته شد.
منابـــع و مراجــــع
۱ - Scrosati, Bruno,Jürgen Garche. "Lithium batteries: Status, prospectsfuture." Journal of Power Sources 195.9 (2010): 2419-2430.
۲ - Linden, David,Thomas B. Reddy. "Handbook of batteries." (1865).
۳ - Vincent, Colin,Bruno Scrosati. Modern Batteries 2nd Edition. Elsevier, 1997.
۴ - Choi, Nam‐Soon, et al. "Challenges Facing Lithium Batterierical Double‐Layer Capacitors." Angewandte Chemie International Edition 51.40 (2012): 9994-10024.
۵ - Srinivasan, Venkat. "Batteries for Vehicular Applications pp." (2008).
۶ - Scrosati, Bruno. "Recent advances in lithium ion battery materials." Electrochimica Acta 45.15 (2000): 2461-2466.
۷ - Johnson, Bradley A.,Ralph E. White. "Characterization of commercially available lithium-ion batteries." Journal of Power Sources 70.1 (1998): 48-54.
۸ - Garche, Jürgen. Encyclopedia of electrochemical power sources. Eds. Chris K. Dyer, et al. Newnes, 2013.
۹ - Masaki, Y., J. Brodd Ralph,K. Akiya. "Lithium-Ion Batteries, ScienceTechnologies." (2009).
۱۰ - van Schalkwijk, Walter,Bruno Scrosati, eds. Advances in lithium-ion batteries. Springer Science & Business Media, 2002.
۱۱ - Ozawa, Kazunori, ed. Lithium Ion Rechargeable Batteries: Materials, Technology,New Applications. John Wiley & Sons, 2012.

