معرفی باتری های لیتیم-یون Li-Ion Battery

توسعه وسایل الکترونیکی مانند گوشیهای تلفن همراه و لب تاپها تقاضا را برای باتریهای قابل شارژ افزایش داده است که در این میان باتریهای لیتیم-یون از دیگر انواع باتریها عملکرد و بازده مناسبتری را از خود نشان داده و بیشترین تولید را در میان دیگر انواع باتریها دارند. این باتریها مانند انواع دیگر باتریها از پیلهای الکتروشیمیایی با دو الکترود و ماده الکترولیت تشکیل شدهاند. در فرایند شارژ باتریهای لیتیمی، در الکترود مثبت لیتیم به یون لیتیم مثبت و در الکترود منفی یون لیتیم به لیتیم فلزی تبدیل شده و در بین لایههای الکترود قرار میگیرد. تحقیقات زیادی در جهت توسعه هر یک از الکترودها و الکترولیت در باتریهای لیتیم یون صورت گرفته است و با ورود نانومواد در این تحقیقات تحولات شگرفی در عملکرد این نوع باتریها به وجود آمده است. این سیر تکاملی با ساخت نانومواد جدید همچنان ادامه دارد. در این مقاله تلاش شده با زبانی ساده این نوع باتریها معرفی شده و مختصری در مورد استفاده از نانومواد در آنها توضیح داده شده است.
این مقاله شامل سرفصلهای زیر است:
1- مقدمه
2- باتری های قابل شارژ
3- معرفی باتریهای لیتیم-یون
4- اجزا باتریهای لیتیم-یون
5- عملکرد باتریهای لیتیم یون
6- الکترودهای باتریهای لیتیم-یون
6-1- الکترود مثبت
6-2- الکترود منفی
7- الکترولیت و افزودنیها
8- بحث و نتیجهگیری
1- مقدمه
در عصر حاضر صنعت الکترونیک پیشرفت چشمگیری نموده است و به دلیل گسترش ارتباطات و فناوری اطلاعات وسایل الکترونیکی قابل حمل همچون گوشیهای تلفن همراه، لبتاپها و ... توسعه یافتهاند. تامین انرژی به صورت آسان و مطلوب برای توسعه این وسایل یک ضرورت مهم و انکارناپذیر است. این تا به حدی است که میتوان باتری را قلب وسایل الکترونیک قابل حمل دانست. همچنین امروزه به دلیل مشکلات ایجاد شده به دلیل آلودگی هوا شرکتهای بزرگ خودروسازی سالانه هزینههای زیادی را صرف ساخت خودروهای الکتریکی و هیبریدی مینمایند که از مهمترین چالشها در ساخت این خودروها تامین انرژی الکتریکی مورد نیاز آنها میباشد. بهترین گزینه برای رفع این مهم استفاده از باتریهای قابل شارژ جهت ذخیرهسازی انرژی الکتریکی در این خودروها میباشد.
با توجه به موارد ذکر شده در بالا تحقیقات وسیعی در زمینه باتریها قابل شارژ در مراکز تحقیقاتی دنیا صورت میپذیرد که باعث پیشرفت بسیار سریع باتریهای قابل شارژ در چند دهه اخیر شده است. در حال حاضر، باتریهای لیتیم-یون در نوک قله این پیشرفت قرار دارند؛ بهطوری که در اغلب وسایل الکترونیکی امروزی از باتریهای لیتیم-یون استفاده میشود و گروههای تحقیقاتی زیادی در سراسر دنیا در حال تحقیق جهت بهبود عملکرد این نوع باتریها هستند. شکل (1) نمونه ای از چند باتری لیتیمی ساخته شده در ابعاد مختلف جهت کاربردهای گوناگون را نمایش میدهد. ورود فناوری نانو به تحقیقات باتریهای لیتیم-یون باعث جهش در روند پیشرفت این باتریها گردیده و تحولات بارزی را در عملکرد آنها ایجاد نموده است. در این مقاله مختصری به توصیح عملکرد این باتریها پرداخته شده است.

شکل 1- نمایی از چند باتری لیتیمی
2- باتری های قابل شارژ
اولین بار در سال 1786 گالوانی شیوه جدیدی برای تولید الکتریسیته به وسیله مواد شیمیایی کشف کرد که بعدها این پیلها به پیلهای گالوانی (Galvanic Cell) مشهور شدند. از سال 1800 به بعد پیشرفت زیادی در زمینه باتریها صورت گرفت اما اولین باتریهای قابل شارژ سرب اسید که امروزه نیز در خودروها از آنها استفاده میشود در سال 1859 ساخته شد. تحول بعدی در باتریهای قابل شارژ در سال 1960 با ساخت باتریهای نیکل-کادمیوم (Ni-Cd) رخ داد اما این باتریها نیز در سال 1990 جای خود را به باتریهای جدید نیکل-هیدرید فلز (Nickel-Metal Hydride) دادند. چرخه پیشرفت باتریهای قابل شارژ با اختراع اولین باتریهای لیتیم-یون در سال 1991 و باتریهای پلیمر-لیتیم یون در سال 1999 کامل گردید. در سال های اخیر با به کارگیری نانوذرات مختلف در این باتریها بازده آنها به مقدار قابل ملاحظهای افزایش یافته است. در ادامه عملکرد آنها معرفی و بررسی شده است [1].
3- معرفی باتریهای لیتیم-یون
باتری وسیلهای است که انرژی شیمیایی را به طور مستقیم به انرژی الکتریکی تبدیل میکند. در واقع یک باتری شامل یک یا چند پیل ولتایی (Voltaic Cell) است که بر اثر واکنشهای شیمیایی اکسید و احیا مولد جریان الکتریسیته هستند. هر پیل ولتایی از دو الکترود تشکیل شده است که بین آنها با الکترولیت پر می شود. الکترولیت محلولی رسانا شامل یونها است. معمولا ترکیبات الکتروفعال درون الکترولیت حل می شوند که میتوانند با الکترودها واکنش شیمیایی بدهند و انرژی شیمیایی را با انتقال بار در سطح مشترک الکترود-الکترولیت به انرژی الکتریکی تبدیل کنند.
ولتاژ خروجی یک باتری به طور مستقیم با ماهیت شیمیایی واکنش الکتروشیمیایی پیل در ارتباط است. به عنوان مثال در باتریهای سرب-اسید، واکنش شیمیایی هر پیل 2 ولت جریان را تولید مینماید. در باتریهای لیتیمی واکنش الکتروشیمیایی صورت گرفته ولتاژ تقریبی 3 ولت را تولید می نماید که تولید این ولتاژ یکی از ویژگیهای مهم این نوع باتریها است. بنابراین با بهره گیری از واکنش های لیتیمی میتوان با به کارگیری تعداد پیل کمتر به ولتاژ بالاتر دست یافت.
4- اجزا باتریهای لیتیم-یون
به طور کلی هر باتری از 3 بخش اصلی الکترود مثبت، الکترود منفی و الکترولیت تشکیل شده است. در باتریهای لیتیم-یون، الکترود مثبت یا کاتد از یک ترکیب لیتیم مانند لیتیم کبالت اکسید و الکترود منفی یا آند از کربن ساخته شده و یک لایه جدا کننده در بین آنها قرار دارد. نمایی از یک پیل باتری لیتیمی در شکل 2 نمایش داده شده است. الکترولیت در باتری های لیتیمی نیز از نمک لیتیم دریک حلال آلی ساخته شده است. استفاده از حلال آلی در نقش الکترولیت به دلیل اشتعال زا بودن نیازمند انجام پاره ای از اقدامات ایمنی است. اقدامات ایمنی و همچنین موارد دیگری که برای بهبود عملکرد باتری های لیتیمی به کار گرفته می شوند، مهندسی ساختار الکترولیت را بسیار پیچیده می نماید. الکترولیت در این باتری ها از مجموعه ای از مواد تشکیل شده که هر کدام وظیفه خاص خود را دارند. نقص در عملکرد هر یک از اجزای الکترولیت باعث نقص در عملکرد کل باتری میشود. در بخشهای بعد هر یک از این اجزا به طور کامل شرح داده میشوند [1].
علاوه بر موارد بالا، باتریهای لیتیمی مجهز به مدارهای الکترونیکی محافظ و فیوزهای جهت جلوگیری از عکس شدن قطبیت، اعمال ولتاژ بیش از حد، گرم شدن بیش از حد و موارد ایمنی دیگر هستند.

شکل2- نمای شماتیک از یک سل باتری لیتیم یون
5- عملکرد باتریهای لیتیم یون
با توجه به موارد ذکر شده در بالا اگر فرض کنیم که یک نمونه از باتری لیتیمی دارای الکترود مثبت لیتیم-کبالت اکسید و الکترود منفی گرافیتی باشد، در فرایند شارژ (Charging) در الکترود مثبت نیم واکنش:
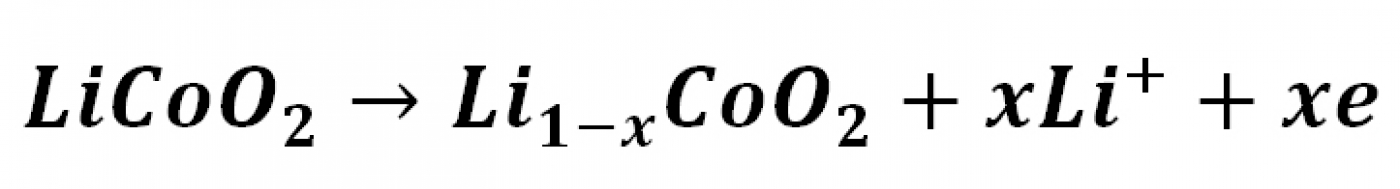
و در الکترود منفی نیم واکنش:
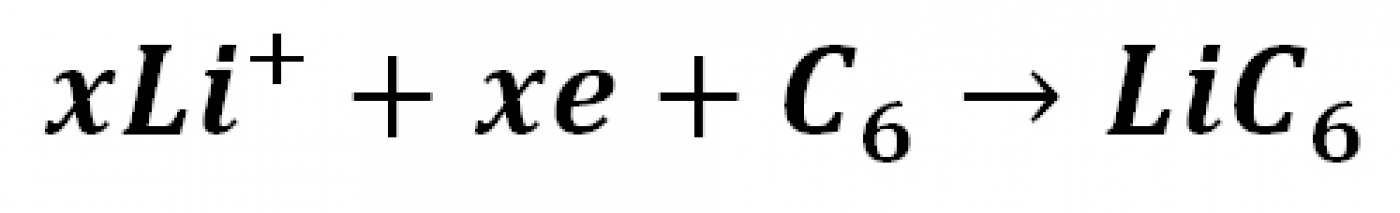
رخ میدهد. در مجموع میتوان گفت که در فرایند شارژ، لیتیم فلزی موجود در ساختار الکترود مثبت به یون لیتیم تبدیل شده و یونهای لیتیم موجود در الکترولیت در بین لایههای کربن (گرافیت) ذخیره میشود. چنین فرآیند هایی که در کل شارژ باتری را باعث می شوند، نیازمند صرف انرژی (الکتریکی) هستند. در فرایند تخلیه شارژ (Discharging) عکس واکنشهای فوق صورت گرفته و انرژی الکتریکی ذخیره شده آزاد میشود. شکل 3 فرایند شارژ و تخلیه شارژ را نمایش می دهد [3،2].
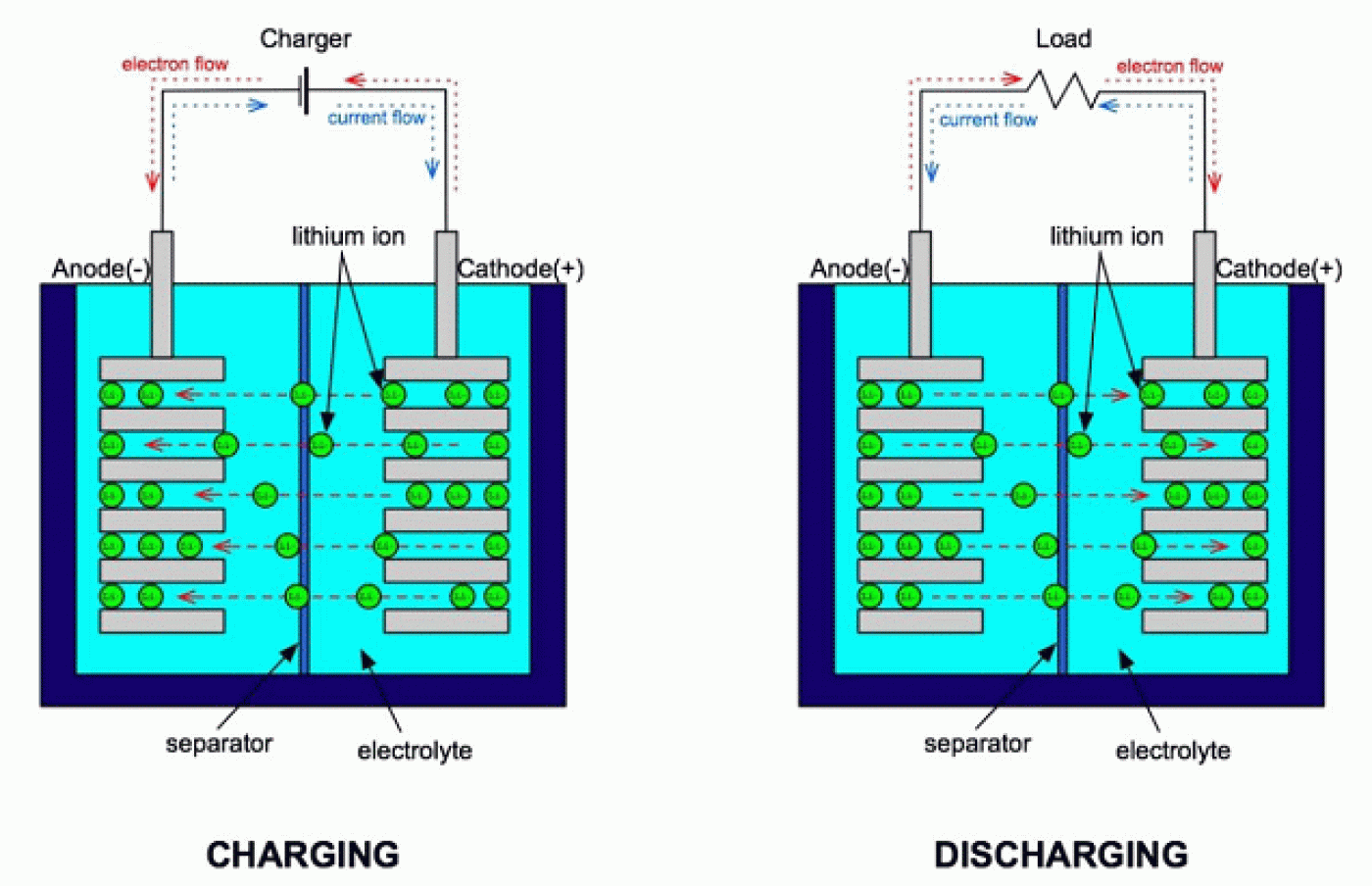
شکل 3- فرایند شارژ و تخلیه شارژ در باتری های لیتیمی
6- الکترودهای باتریهای لیتیم-یون
6-1- الکترود مثبت
الکترود های مورد استفاده در باتری های قابل شارژ باید دارای واکنش برگشتپذیر، هدایت الکتریکی بالا و واکنش الکتروشیمیایی سریع باشند. همچنین الکترودها باید ساختاری پایدار داشته و در چرخههای مختلف شارژ و تخلیه شارژ دستخوش تغییر نشوند.
تحقیقات زیادی برای دستیابی به الکترودی با ویژگیهای مناسب انجام گرفته و گستره وسیعی از الکترودها طراحی و ساخته شده است. یکی از انواع الکترودهای مورد استفاده لیتیم-کبالت اکسید است. این نوع الکترود به صورت تجاری در دسترس است و باتریهای ساخته شده با این الکترود دارای ظرفیت مناسب (ظرفیت یک باتری مقداری از الکتریسیته است که باتری می تواند ذخیره کند)، انرژی و توان بالا و طول عمر نسبتا مناسب است.
در ابتدا برای سنتز این ماده از ترکیب کردن اکسیدها و کربناتهای مناسب و سپس حرارت دادن تا دمای بالای 900 درجه سانتیگراد استفاده میشد. در نهایت مواد سنتز شده به یکدیگر سایید شده و پرس میشدند که باعث تولید الکترودهایی با ساختار غیریکنواخت میگردید. با پیشرفت روشهای جدید سنتز نانو مواد مانند سل-ژل (Sol-gel) الکترودهای جدید با ذرات همگن و یکنواخت ساخته شدهاند که عملکردی بسیار مطلوبتر دارند[4]. امروزه تحقیقات زیادی برای ساخت نانومواد جدید جهت استفاده در باتریهای لیتیمی در سراسر دنیا انجام میشود که هر روز باتریهایی با طول عمر بیشتر و بازده بالاتر تولید میشود. شکل 4- الف نمای کلی یک الکترود مثبت را نمایش می دهد.
دسته دیگری از مواد که میتوانند نامزد استفاده به عنوان الکترود مثبت باتریهای لیتیم یون باشند، نانو لولهها و نانو سیمها در اندازههای مختلف هستند. به عنوان مثال نانو لوله اکسید وانادیوم (V2O5) و نانو سیمهایی که در بین ساختار لایهای خود پذیرنده لیتیم هستند از این دسته اند. ساختارهایی مانند نانو سیم LiCoO2 و Li(Ni1/2Mn1/2)O2 تهیه شده و به عنوان میزبان بین لایهای در الکترود مثبت باتریهای لیتیم یون مورد استفاده قرار گرفته است. این دسته از الکترودها قابلیت بسیار خوبی را از جمله افزایش بازده، افزایش قدرت و سرعت نسبت به مواد تودهای از خود نشان می دهند [4].
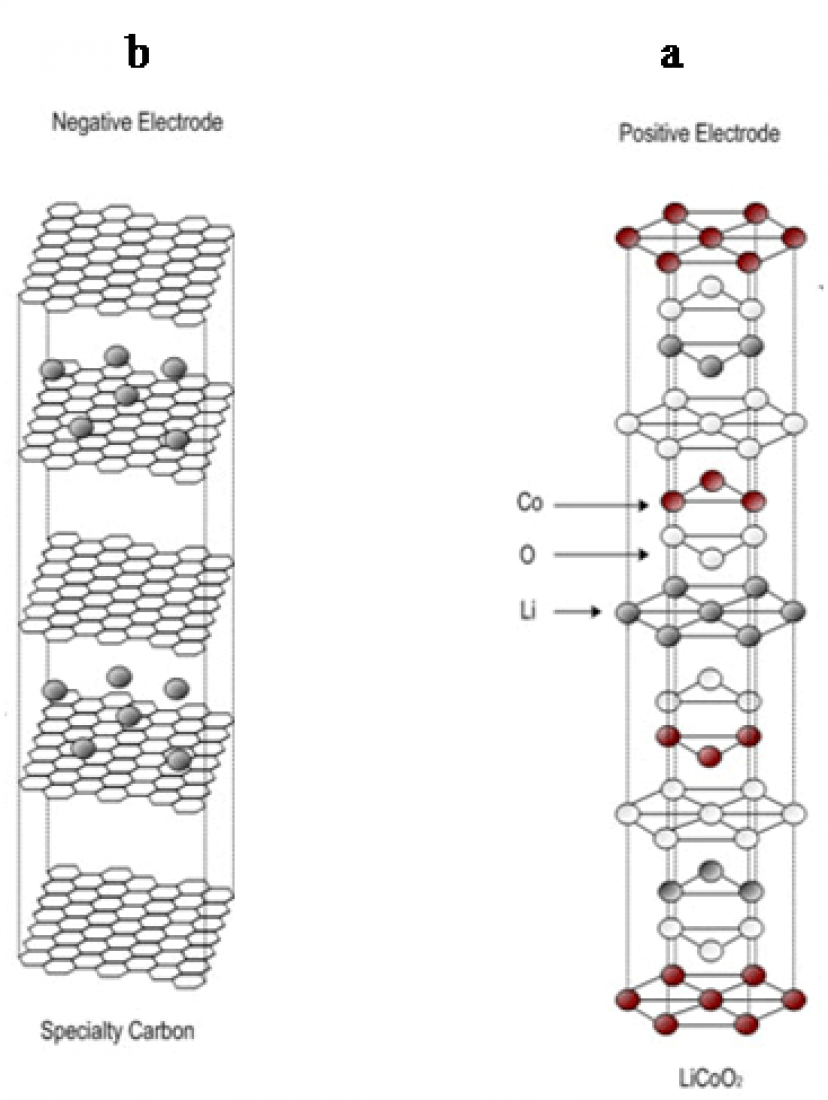
شکل 4- نمای کلی الف) الکترود مثبت ، ب) الکترود منفی
6-2- الکترود منفی
ترکیبات کربنی میتواند ساختارهای متفاوت و در نتیجه خصوصیاتی متفاوت داشته باشند. گرافیت که یکی از متداولترین ساختارهای کربن است، دارای لایههای کربنی با هیبرید Sp2 میباشد. گرافیت دارای هدایت الکتریکی بالا در درون لایهها می باشد که به دلیل تحرک الکترونهای π (الکترون های غیر مستقر) می باشد. در مقابل هدایت الکتریکی گرافیت در بین لایهها کم می باشد. این ساختار ویژه کربن در گرافیت باعث می شود که لیتیم بتواند به راحتی در بین لایههای آن قرار گیرد و واکنش تبادل الکترون را انجام دهد. شکل 4- ب نمای کلی یک الکترود منفی را نمایش می دهد.
7- الکترولیت و افزودنیها
مهمترین تفاوت بین پیلهای معمولی و باتریهای لیتیم استفاده از حلالهای آلی بجای آب به عنوان پایه الکترولیت است. در باتریهای لیتیمی یون +Li ارتباط الکتریکی بین دو الکترود را بر قرار مینماید و در دو الکترود تبادل الکترون انجام میدهد. برای حصول پایداری و یکنواختی در خروجی باتری و همچنین برای محافظت الکترودها و عوامل دیگر، علاوه بر نمک لیتیم، مواد دیگری نیز به الکترولیت اضافه میشود. از این مواد تحت عنوان افزودنیها (Additive) یاد میشود. البته این مواد کمتر از 5 درصد از کل محلول الکترولیت را تشکیل میدهند اما همین مقدار کم نقش حیاتی در عملکرد باتری داشته و عدم وجود آنها موجب از کار افتادن سریع باتری میشود. الکترولیت مایع معمولا محلول استاندارد لیتیم هگزافلوئوروفسفات (LiPF6) در مخلوطی از آلکیل کربناتها (Alkyl Carbonates) مثل اتیلن کربنات، دی اتیل کربنات و ... میباشد.
در باتریهای لیتیم-یون با الکترولیت مایع، لایه الکترولیت جامد (, SEI Solid Electrolyte Interface) در سطح مشترک الکترولیت و الکترود تشکیل می شود. در واقع بعد از ساخت پیل این لایه الکترولیتی جامد به طور خود بخود بر سطح الکترود تشکیل می شود. تشکیل یک لایه پایدار و مقاوم از اهمیت بالایی برخوردار است. تشکیل SEI با ساختاری نارسانا، ناپایدار و ... می تواند کارآیی باتری را تضعیف نماید. همچنین با مصرف برگشت ناپذیر یون های الکترولیت، طول عمر باتری را کاهش داده و باتری را غیرقابل شارژ می کند. استفاده از افزودنی ها، برگشت ناپذیری پیل را کاهش داده، از تشکیل گاز در مسیر تشکیل SEI ممانعت نموده و باعث طولانیتر شدن عمر باتری شوند. همچنین افزودنیها باعث بهبود پایداری دمایی LiPF6 در حلالهای آلی شده و از حل شدن مواد کاتد در مواقعی که باتری بیش از حد شارژ میشود محافظت مینمایند. برخی از افزودنیها خواص فیزیکی الکترولیت مثل هدایت یونی، ویسکوزیته، توانایی ترشدگی برای جداکنندههای پلیالفینی و ... را بهبود میدهند. برخی دیگر با کاهش آتشگیری الکترولیت آلی، ارتقا تحمل باتری در مقابل شارژ شدهگی بیش از حد (Overcharge) موجب امنیت بیشتر باتریها می شوند. در این حالت افزودنی باعث ختم عملکرد باتری در مواردی که از باتری به طور نامناسب استفاده میشود میگردد. این مواد به طور موثری باعث تشکیل SEI با ساختارهای بهبود یافته میشوند که تاثیرات مخرب کمتری بر عملکرد کل باتری می گذارد. بر این اساس افزودنیها را میتوان به طور کلی به 5 دسته تقسیم نمود که عبارتند از:
1-بهبود دهندههای سطح SEI
تحقیقات وسیع و گستردهای که با استفاده از روش های طیف سنجی مختلف صورت گرفته مشخص نموده است که SEI از تجزیه حلالها و نمکهای الکترولیت تولید میگردد. این اجزا شامل Li2CO3، لیتیم آلکیل کربنات، لیتیم آلکوکسید، بخشهای نمکی دیگر مثل LiF برای الکترولیتهای با پایه LiPF6 میباشند.
اگر بخواهیم به طور ساده نحوه تشکیل SEI را توضیح دهیم به طور کلی دو مکانسیم برای کاهش الکتروشیمیایی حلالهای با پایه کربنات میتوان در نظر گرفت. به عنوان مثال برای حلال اتیلن کربنات مکانیسمهای پیشنهاد شده در شکل 5 میتواند رخ دهد.

شکل 5- دو مکانیسم پشنهادی برای تشکیل SEI
در اینجا RAنشان دهنده رادیکال آنیون(Radical Anion) است. هر دو مکانسیم در فرایند تشکیل SEI حضور داشته و در رقابت با یکدیگر میباشند. وقتی که فرایند یک بیشتر اتفاق افتد کاهش حلال آلی محصولات گازی بیشتری را تولید نموده (گاز اتیلن)، SEI تشکیل شده شامل مقادیر فراوان Li2CO3 بوده و ناپایدار میباشد. برعکس در مکانسیم دوم محصولات گازی کمتری ایجاد شده و تولیدات حاصل به طور مناسبی در الکترولیت نامحلول میباشند و در نتیجه تشکیل SEI پایدار و متراکم مینمایند. بنابراین در پیلهای لیتیم-یون مطلوب این است که مکانسیم دوم بیشتر رخ دهد زیرا تولید گاز در مکانسیم اول باعث کاهش پایداری و یکنواختی SEI میشود [5].
این نوع از افزودنی ها در فرایند تشکیل SEI دخالت نموده و این فرایند را با مکانیسم دوم شرح داده شده در بالا (شکل 5) پیش می برند. تحقیقات زیادی بر روی عوامل موثر بر این دو مکانسیم انجام شده است که به عنوان یک نتیجه ریخت شناسی (Morphology) و شیمی سطح گرافیت و فعالیت کاتالیزوری آن بر مسیر مکانسیم بسیار موثر هستند. اثر کاتالیستی گرافیت به شدت به موقعیت گرافیت وابسته است و جنس SEI تشکیل شده را تغییر می¬دهد به طوری که SEI تشکیل شده در لبههای (Edges) یک گرافیت پیرولیتی (Pyrolitic Graphite) غنی از مواد معدنی است در حالی که SEI در قائده های صفحه ای (Basal Plane) غنی از مواد آلی می باشد. اصلاح سطح گرافیت با روش های مختلف فیزیکی و شیمیایی باعث بهبود پدیده کاتالیستی میشود. به عنوان مثال اکسیداسیون ملایم و پوشش فیزیکی بعضی مواد بر روی سطح گرافیت به طور موثری تشکیل SEI را تسهیل نموده و تولید گاز را در مراحل اولیه قرارگیری لیتیم در بین لایه های گرافیت کاهش می دهد.
2- عوامل محافطت کننده کاتد
زوال و کاهش بازده کاتد از نقطه نظر الکترولیت از دو فاکتور منشا می گیرد: اول وجود آب و ناخالصی های اسیدی و دوم اکسیداسیون برگشت ناپذیر حلال های الکترولیت. از آنجایی که میزان آب و ناخالصی های اسیدی (HF) در الکترولیت قبل از ساخت پیل به دقت کنترل میشود اساساً این ناخالصیها در طول فرایند شارژ و به ویژه در مواقع فراشارژ (Overcharging) تولید میشوند.
یک مکانسیم پیشنهادی برای تولید آب این است که حلال به طور الکتروشیمیایی با اکسیژن آزاد شده از کاتد اکسید شده و تولید آب و CO2 مینماید. آب حاصل نیز موجب هیدرولیز LiPF6 به محصولات اسیدی مثل HF و POF3 میشود. از آنجایی که HF منبع اصلی انحلال مواد کاتد است، در سال های اخیر تلاش های زیادی در جهت گسترش افزودنی های تمیز کننده آب و اسید صورت گرفته است. از مواد قابل استفاده برای این منظور ترکیبات آلی با پایه آمین مانند بوتیل آمین برای جذب ناخالصی اسید می باشد. همچنین می توان از ترکیبات با پایه کربودی آمید مانند N,N دی سیکلوهگزیل کربودی آمید که با آب واکنش داده و از تولید اسید جلوگیری می کند نیز استفاده نمود.
3- نمکهای پایدار کننده LiPF6
ناپایداری گرمایی الکترولیت هایی که بر پایه LiPF6 هستند به دلیل دو فاکتور مهم میباشد: اولاً ثابت تعادل واکنش تولید PF5 بزرگ بوده (LiPF6↔LiF+PF5) و ثانیاً واکنش پذیری PF5 حاصل با حلال های آلی بسیار بالا میباشد. بر این اساس PF5 قادر خواهد بود تا یک سری از واکنش ها را با اکثر اجزای SEI مثل Li2CO3 RCO2Li ,ROCO2Li انجام دهد. در این صورت حتی در غیاب آب و اسیدهای ناخالص دیگر می تواند پایداری سطح گرافیت را از بین ببرد.
اولین تلاش ها برای حل کردن دو مشکل بالا انحلال کمتر از 0.05 درصد وزنی LiF درون الکترولیت با پایه LiPF6 بود که تولید گاز را کاهش میدهد. این بهبود بخشیدن را میتوان به ممانعت از واکنش تجزیهای به وسیله مقدار زیادی از LiF بر اساس اصل تعادلات شیمیایی نسبت داد (اصل لوشاتلیه- Le Chatelier's Principle). مشکل دوم یعنی واکنش پذیری بالای PF5 را با اضافه کردن مقادیر کم باز لوئیس می توان حل نمود. باز لوئیس ساختاری الکترون دهنده است که کمبود الکترونی PF5 (اسید لوئیس) را جبران نموده و واکنش پذیری آن را کاهش می دهد.
4-عوامل محافظت کننده امنیت
نگرانی امنیت مانع اصلی در بکارگیری باتریهای لیتیم یون هنگام استفاده در وسایل نقلیه و وسایل الکترونیکی است. این نگرانی از حضور الکترولیتهای مایع کاملا اشتعال پذیر در باتریها نشات است. بنابراین تحقیقات وسیعی بر روی افزودنیهای بازدارنده آتش انجام شده است. ترکیبات آلی فلورینه شده فسفات یکی از مهمترین بازدارندههای آتش در باتریهای لیتیم یون هستند که به دلیل وجود فسفر در ساختار با به دام اندازی رادیکال های ناشی از فرایندهای زنجیره ای احتراق مانع از گسترش احتراق می شوند.
5-بهبود دهندههای رسوب Li
این نوع افزودنیها برای بهبود بازده چرخهای لیتیم فلزی (تبدیلات متناوب لیتیم فلزی به یون در واکنش های بین کاتد و آند) در باتریهای قابل شارژ مورد استفاده قرار گرفتهاند. این نوع افزودنیها اهمیت زیادی در پیشرفت باتریهای با قدرت بالا دارند. در حقیقت کاهش قدرت باتریهای لیتیم مربوط به رسوب صفحات لیتیم در آند گرافیتی است. رشد نامطلوب این ساختارها در SEI در مواقع شارژ در زمانهای طولانی با جریان ثابت یا در سرعتهای بالا و دماهای پایین رخ میدهد.
اصولا چرخه پذیری ضعیف لیتیم فلزی به دو فاکتور نسبت داده میشود: 1- واکنش پذیری بالای لیتیم با حلالهای الکترولیت 2- ریخت شناسی ضعیف لیتیم صفحهای شده مثل تشکیل دندریتهای سوزن مانند و لیتیم اسفنجی متخلخل. مورد اول به خواص ذاتی لیتیم مربوط است و بنابراین بیشتر تحقیقات در بخش دوم یعنی اصلاح مرفولوژی لیتیم تمرکز یافته است. یک ایده مناسب بر این است که یک لایه سطحی یون-هادی و یا یک لایه آلیاژی لیتیم-فلز تشکیل گردد تا رسوب یکنواخت لیتیم را تسهیل نماید.
تحقیقات نشان داده است که غلظتهای پایین در حد ppm ترکیبات آلی مثل، پلی سولفیتها، SO2, CO2 در بهبود اثر چرخهی لیتیم موثر هستند. همچنین سورفاکتانت های (Surfactants) یونی و غیر یونی برای بهبود بازده چرخهای باتری های لیتیمی پیشنهاد میشود.
6- تحولات الکترولیت ها
الکترولیتها نیز دستخوش تحولات بسیاری شده و سیر تکاملی سریعی را طی نمودهاند. در ابتدا در ساختار باتریهای لیتیومی از الکترولیتهای مایع استفاده میشده که بعد با افزودن نانومواد به آنها عملکردشان بهبود داده شده است. در تحول بعدی از الکترولیتهای پلیمری استفاده شد و در مراحل بعد نیز، الکترولیتهای پلیمری با افزودن نانو مواد تکامل یافتند.
در نگاه اول ممکن است شگفت انگیز به نظر برسد که چگونه نانو مواد میتوانند بر خواص متعارف الکترولیت های مایع مورد استفاده در باتریهای لیتیم یون تاثیر بگذارند. این در حالی است که شواهد و مدارک زیادی در بهبود عملکرد باتریها با استفاده از این مواد وجود دارد. به عنوان مثال اضافه کردن نانو پودرها از ترکیباتی مانند Al2O3، SiO2 و ZrO2 به الکترولیت غیرآبی میتواند هدایت الکتریکی را تا 6 برابر افزایش دهد. شکل6 نمودار افزایش هدایت الکترولیت را با اضافه کردن نانومواد نمایش می دهد.

شکل 6-هدایت کامپوزیتهای مختلف بر اساس کسر حجمی (Φ) از اکسیدهای مختلف
بحث در مورد هر یک از انواع الکترولیتها و افزودنیها بسیار وسیع است به طوری که هر کدام از آنها به عنوان یک زمینه تحقیقاتی قابل بررسی است. در اینجا تنها به معرفی پرداخته شده است و توضیح درباره ساختار و نحوه عملکرد هر سامانه به دلیل گستردگی و پیچیدگی بحث در مقالات بعدی ارائه میگردد [5].
8- بحث و نتیجهگیری
باتری های لیتیم-یون نقش اساسی در توسعه وسایل الکترونیکی قابل حمل دارند، بنابراین تحقیقات وسیعی برای توسعه آنها صورت گرفته است. این نوع از باتریهای قابل شارژ مانند دیگر انواع باتریها از پیلهای الکتروشیمیایی تشکیل شدهاند. هر پیل نیز به نوبه خود از دو الکترود تشکیل شده که به وسیله الکترولیت با یکدیگر ارتباط می گیرند. هر یک از اجزا دارای ساختار ویژه و منحصر به فرد میباشند. در این میان، نانو مواد تحولات شگرفی را در بازده و طول عمر باتریهای لیتیمی ایجاد نمودهاند. در این مقاله با رویکرد آموزشی به توضیح کلی در مورد هر یک از اجزا و عملکرد آن ها پرداختیم. در مقالات بعد، جزئیات هر بخش به طور کامل به همراه نقش نانو مواد در مسیر پیشرفت آنها بیان خواهد شد.
منابـــع و مراجــــع
۱ - Wakihara, M., Recent developments in lithium ion batteries. Materials ScienceEngineering: R: Reports,. 33(4): p. 109-134. 2001
۲ - Huang, S., et al., Improvement of the high-rate discharge properties of LiCoO2 with the Ag additives. Journal of Power Sources, 148: p. 72-77, 2005.
۳ - . Lu, C.H.P.Y. Yeh, Surfactant effects on the microstructureelectrochemical properties of emulsion-derived lithium cobalt oxide powders. Materials ScienceEngineering B, 84(3): p. 243-24, 2001.
۴ - Peng, Z., C. Wan,C. Jiang, Synthesis by sol–gel processcharacterization of LiCoO2 cathode materials. Journal of Power Sources, 72(2): p. 215-22, 1998.
۵ - Zhang, S.S., A review on electrolyte additives for lithium-ion batteries. Journal of Power Sources, 162(2): p. 1379-139, 2006.

