باتری لیتیومی چیست؟

در این آموزش، یکی از انواع مهم و پرکاربرد باتریها، یعنی باتری لیتیومی را معرفی میکنیم.
توان برای حرکت؛ این همان کار باتری است. باتریها به راحتی برق را برای مصارف کوچک و قابل حمل ما تأمین میکنند. اما مشکلی وجود دارد که اکثر باتریها خیلی زود تخلیه میشوند و اگر از شارژر مخصوص استفاده نکنیم، مجبوریم آنها را دور بیندازیم. این کار از نظر اقتصادی با چالش همراه است و برای محیط زیست نیز مضر است؛ در سراسر جهان، ما سالانه میلیاردها باتری یکبار مصرف را دور میاندازیم. باتریهای قابل شارژ به حل این مشکل کمک میکنند و معروفترین نوع آنها باتری «یون لیتیوم» (Lithium ion) است که به باتری لیتیومی یا باتری لیتیوم یون نیز معروف شده است. تلفن همراه، لپتاپ و پخشکننده MP3 احتمالاً از آشناترین وسایلی هستند که از باتری لیتیومی استفاده میکنند. باتریهای لیتیومی تقریباً از سال 1991 مورد استفاده گسترده قرار گرفتهاند، اما شیمی اولیه آنها برای اولین بار توسط »گیلبرت لوئیس» (Gilbert N. Lewis)، شیمیدان آمریکایی (1875-1946)، در سال 1912 کشف شد.
باتریهای لیتیومی در انواع فناوریهای قابل حمل از مسواکهای برقی و تبلتها گرفته تا ماشینهای الکتریکی و کامیونها کاربرد دارند. در این ادامه این آموزش، نگاهی دقیقتر به نحوه کار باتری لیتیومی خواهیم انداخت.
باتریهای غیر قابل شارژ
باتریهای معمولی مانند روی-کربن و قلیایی را نمیتوان دوباره شارژ کرد، زیرا واکنشهای شیمیایی تولیدکننده انرژی در آنها برگشتپذیر نیست. هنگامی که انرژی الکتریکی این باتریها مصرف شود، هیچ راهی برای پر کردن مجدد آنها وجود ندارد.

میدانید که کار باتری اساساً یک آزمایش شیمیایی است که در یک قوطی فلزی کوچک اتفاق میافتد. اگر دو انتهای باتری را به چیزی مانند چراغ قوه متصل کنید، واکنشهای شیمیایی آغاز میشود: مواد شیمیایی داخل باتری به آرامی اما به طور نظاممند از هم جدا میشوند و برای تشکیل سایر مواد شیمیایی، به هم میپیوندند و جریانی از ذرات دارای بار مثبت به نام یون و الکترون دارای بار منفی را تولید میکنند. یونها در باتری حرکت میکنند، الکترونها در مداری که باتری به آن متصل است گردش میکنند و موجب تولید انرژی الکتریکی میشوند که چراغ قوه را روشن میکند. تنها مشکل این است که این واکنش شیمیایی میتواند فقط یک بار و فقط در یک جهت اتفاق بیفتد. به همین دلیل باتریهای معمولی را نمیتوان دوباره شارژ کرد.
باتریهای قابل شارژ
مواد شیمیایی مختلفی در باتریهای قابل شارژ استفاده میشود که با واکنشهای کاملاً متفاوت از هم جدا میشوند. تفاوت عمده این است که واکنشهای شیمیایی در یک باتری قابل شارژ برگشتپذیر هستند. هنگامی که باتری در حال تخلیه است، واکنشها یکطرفه میشوند و باتری برق میدهد و زمانی که باتری در حال شارژ است، واکنشها برعکس میشوند و باتری انرژی را ذخیره میکند. این واکنشهای شیمیایی میتواند صدها بار در هر دو جهت اتفاق بیفتد، بنابراین یک باتری قابل شارژ معمولاً از ۲ یا ۳ تا 10 سال عمر مفید دارد (بسته به اینکه چقدر از آن میشود و به چه میزان مراقبت میشود).
نحوه کار باتری لیتیومی
یک باتری لیتیومی، مانند باتری لپتاپ تصویر زیر، از تعدادی واحد تولید برق به نام سلول ساخته شده است که ولتاژ هر کدام تقریباً 3 تا 4 ولت است. بنابراین یک باتری لیتیومی که ولتاژ آن 10 تا 16 ولت است، معمولاً به سه تا چهار سلول نیاز دارد. باتری تصویر زیر 10٫8 ولت دارد و دارای سه سلول است.

مانند هر باتری دیگری، یک باتری لیتیومی قابل شارژ از یک یا چند واحد تولید برق به نام سلول ساخته میشود. هر سلول اساساً دارای سه بخش است: یک الکترود مثبت (متصل به ترمینال مثبت باتری یا +) ، یک الکترود منفی (متصل به ترمینال منفی یا -) و یک ماده شیمیایی به نام الکترولیت در بین آنها. الکترود مثبت معمولاً از یک ترکیب شیمیایی به نام لیتیوم کبالت اکسید (LiCoO2) یا در باتریهای جدیدتر از لیتیوم آهن فسفات (LiFePO4) ساخته میشود. الکترود منفی به طور کلی از کربن (گرافیت) ساخته میشود و الکترولیت یک نوع باتری نسبت به نوع دیگر متفاوت است که البته در درک ایده اساسی نحوه کار باتری تأثیری ندارد.
باتریهای لیتیوم یون نسبت به باتریهای حاوی فلزات سنگین مانند کادمیوم و جیوه آسیب کمتری به محیط زیست میرسانند، اما بازیافت آنها هنوز نسبت به سوزاندنشان یا انتقال آنها به محل دفن زباله ترجیح داده میشود.

شارژ و تخلیه باتری لیتیومی
تصویر متحرک زیر شارژ و تخلیه باتری لیتیومی را نشان میدهد.
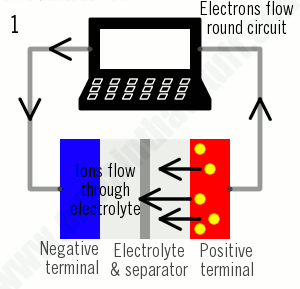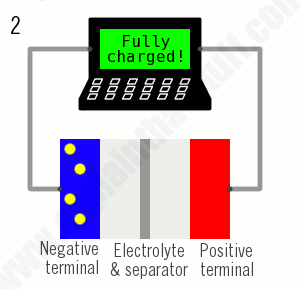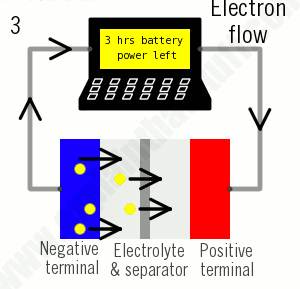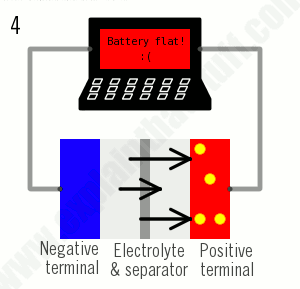
همانطور که از نام آنها پیداست، باتریهای یون لیتیوم تماماً بر اساس حرکت یونهای لیتیوم کار میکنند. یونها هنگام شارژ شدن باتری به یک طرف حرکت میکنند (وقتی که توان جذب میشود) و هنگام تخلیه باتری (برای تأمین برق) برعکس حرکت میکنند:
- هنگام شارژ، یونهای لیتیوم (دایرههای زرد) از الکترود مثبت (قرمز) به الکترود منفی (آبی) از طریق الکترولیت (خاکستری) جریان مییابند. الکترونها نیز از الکترود مثبت به سمت الکترود منفی جریان مییابند، اما مسیر طولانیتری را در اطراف مدار بیرونی طی میکنند. الکترونها و یونها در الکترود منفی ترکیب میشوند و لیتیوم را در آنجا رسوب میدهند.
- وقتی دیگر هیچ یونی جریان پیدا نمیکند، باتری کاملاً شارژ شده و آماده استفاده است.
- هنگام تخلیه، یونها از طریق الکترولیت از الکترود منفی به الکترود مثبت برمیگردند. الکترونها از طریق الکترود منفی به سمت الکترود مثبت جریان مییابند و لپتاپ را شارژ میکنند. وقتی یونها و الکترونها در الکترود مثبت با هم ترکیب میشوند، لیتیوم در آنجا رسوب میکند.
- وقتی تمام یونها به عقب برگشتند، باتری کاملاً تخلیه شده و دوباره نیاز به شارژ دارد.
اما یونهای لیتیوم چگونه ذخیره میشوند؟ تصویر متحرک زیر، نحوه ذخیره یونهای لیتیوم در الکترود گرافیت منفی (چپ) و الکترود اکسید کبالت مثبت (راست) را نشان میدهد.
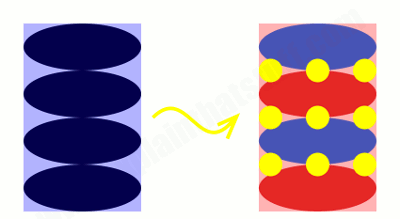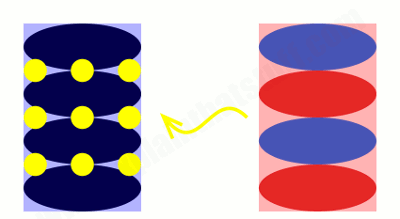
این تصویر متحرک، با جزئیات بیشتری آنچه را که در باتری اتفاق میافتد، نشان میدهد. مجدداً، الکترود گرافیت منفی (آبی) در سمت چپ، الکترود مثبت اکسید کبالت (قرمز) در سمت راست نشان داده شده و یونهای لیتیوم با دایرههای زرد مشخص شدهاند.
هنگامی که باتری کاملاً شارژ میشود، تمام یونهای لیتیوم بین لایههای گرافن (ورقهای کربن به ضخامت یک اتم) در الکترود گرافیت ذخیره میشوند (همه آنها به سمت چپ منتقل شدهاند). در این حالت شارژ، باتری در واقع یک ساندویچ چندلایه است و لایههای گرافن با لایههای یون لیتیوم جایگزین میشوند.
با تخلیه باتری، یونها از الکترود گرافیت به الکترود اکسید کبالت (از چپ به راست) حرکت میکنند. وقتی باتری کاملاً تخلیه شود، همه یونهای لیتیوم به سمت الکترود اکسید کبالت در سمت راست حرکت کردهاند. یک بار دیگر، یونهای لیتیوم به صورت لایهای در بین لایههای یون کبالت (قرمز) و یون اکسید (آبی) قرار میگیرند. با شارژ و تخلیه باتری، یونهای لیتیوم از یک الکترود به الکترود دیگر رفت و برگشت میکنند.
مزایای باتری لیتیومی
به طور کلی، باتریهای یون لیتیوم از فناوریهای قدیمیتر مانند نیکل-کادمیوم (NiCd) مطمئنتر هستند و از مشکلی به نام «اثر حافظه» (Memory Effect) رنج نمیبرند (به دلیل اثر حافظه، شارژ باتریهای نیکل-کامیوم، مگر در حالتی که کاملاً تخلیه شوند، سخت میشود). از آنجا که باتریهای لیتیوم یون فاقد کادمیوم (یک فلز سمی و سنگین) هستند، حداقل از نظر تئوری، سازگاری بهتری با محیط زیست دارند. اگرچه هر باتری از فلزات، پلاستیکها و سایر مواد شیمیایی مختلف ساخته شده و در نهایت، دفن زبالههای ناشی از آن هرگز چیز خوبی نیست. در مقایسه با باتریهای قابل شارژ سنگین (مانند باتریهای سرب-اسید که در خودرو استفاده میشوند)، باتریهای یون لیتیوم نسبت به مقدار انرژیای که ذخیره میکنند، نسبتاً سبک هستند.

تصویر بالا باتریهای لیتیومی سبک خودروهای برقی شرکت تسلا رودستر را نشان میدهد. تقریباً 3٫5 ساعت طول میکشد تا 6831 سلول لیتیومی آن شارژ شوند. این باتریها در مجموع نیم تن وزن دارند و با شارژ کامل، قابلیت طی مسافتی بیش از 350 کیلومتر را به خودرو میدهند. در تصویر سمت چپ، میتوانید سیم زردی را که باتریها را شارژ میکند مشاهده کنید.در تصویر سمت راست نیز میبینیم که باتریها در محفظه بزرگی هستند روی چرخ عقب قرار گرفتهاند.
معایب باتری لیتیومی
اگر بخواهیم معایب باتری لیتیومی را بیان کنیم، باید به این نکته توجه کنیم که آنها را با چه چیزی مقایسه میکنیم. به عنوان منبع تغذیه خودرو، واقعاً باید آنها را نه با انواع دیگر باتریها بلکه با بنزین مقایسه کنیم. با وجود پیشرفتهای قابل توجه در طول سالها، باتریهای قابل شارژ هنوز فقط کسری از مقدار انرژی گاز معمولی را ذخیره میکنند. به عبارت علمیتر، باتریها چگالی انرژی بسیار کمتری دارند (انرژی کمتری را در واحد جرم ذخیره میکنند). این یعنی میتوانید در عرض چند دقیقه خودروی با سوخا گاز را «شارژ مجدد» (سوختگیری مجدد) کنید، در حالی که به طور کلی شارژ مجدد باتریها در یک خودروی الکتریکی ساعتها طول میکشد.
علاوه بر این، باید به خاطر داشته باشید که این معایب با مزایایی از جمله اقتصادی بودن انرژی بیشتر خودروهای برقی و کمتر بودن نسبی آلودگی هوا متعادل میشوند.
اگر باتری لیتیومی وسیلهای برای تخلیه گازهای تولید شده در هنگام شارژ (عمدتاً مونوکسید کربن، دی اکسید کربن و هیدروژن) نداشته باشد، ممکن است مانند بالشتکهای کوچک باد شود. در تصویر زیر دو باتری یکسان تلفن همراه نشان داده شده است که ضخامت یکی از آنها به دلیل گیر افتادن گازها در داخل آن تقریباً دو برابر شده است.

اما اگر وسایل نقلیه را کنار بگذاریم و به طور کلی باتریهای لیتیومی را در نظر بگیریم، چه معایبی وجود دارد؟ بزرگترین مسئله ایمنی باتری است. باتریهای لیتیومی در صورت شارژ بیش از حد و یا سوء عملکرد داخلی اتصال کوتاه میشوند و آتش می گیرند. در هر دو حالت، باتریها در حالت «ناپایداری حرارتی» گرم میشوند و در نهایت آتش میگیرند یا منفجر میشوند. این مشکل با یک قطع کننده مدار داخلی، معروف به دستگاه قطع جریان یا CID، حل میشود که در صورت گرم شدن بیش از حد باتریها یا افزایش فشار داخلی، جریان شارژ را از قطع میکند.
اما نگرانیها همچنان وجود دارد و در سال 2016، سازمان بینالمللی هوانوردی غیرنظامی (ICAO) رسماً حمل باتریهای لیتیومی در هواپیماهای مسافربری را به دلیل خطر احتمالی ممنوع کرد. امروزه خطرات ایمنی باتریهای لیتیومی توجه بسیاری از رسانهها را به خود جلب کرده است؛ به ویژه از ان زمان که موجب آتشسوزی در خودروهای برقی یا هواپیما شده است.
اما لازم به یادآوری است که در این فناوری رایج در هر تلفن همراه مدرن، لپتاپ، تبلت و اکثر وسایل قابل شارژ، موارد آتشسوزی کمی افتاده است. علاوه بر این، ما باید خطرات گزینههای دیگر را نیز در نظر بگیریم؛ باتریهای یون لیتیوم در خودروهای الکتریکی میتوانند آتش بگیرند، اما خودروهای بنزینی خیلی بیشتر آتش میگیرند و باعث انفجارهای بزرگ میشوند. باتریهای دیگر نیز در صورت گرم شدن بیش از حد ممکن است آتش بگیرند و منفجر شوند. بنابراین آتشسوزی مشکلی نیست که فقط در فناوری باتری لیتیومی وجود داشته باشد.
اما راهحل چیست؟ یک گزینه امیدوارکننده، در حال حاضر توسط شرکتی به نام Ionic Materials، استفاده از پلیمرهای مقاوم در برابر شعله (پلاستیکهای جامد) به جای الکترولیتهای مایع قابل اشتعال است که به طور معمول در باتریهای لیتیومی استفاده میشود. گزینه دیگر را «جان گودنوف» (John Goodenough)، شیمیدان باتریهای یون لیتیوم، پیشنهاد داده که استفاده از شیشه «آلاییده» (برای ایجاد هدایت الکتریکی شیشه) در الکترولیت است.
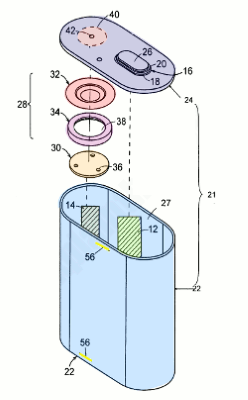
شکل زیر یک باتری لیتیومی دارای یک دستگاه قطع جریان (CID) در داخل آن را نشان میدهد تا از گرم شدن بیش از حد آن جلوگیری کند. در اینجا بخشی از چگونگی عملکرد آن را بیان میکنیم. دو الکترود باتری (سبز، 12 و 14) درون یک محفظه (آبی روشن، 22) با درپوشی در بالا قرار دارند (آبی تیره، 24). یکی از الکترودها (14) از طریق دستگاه قطع جریان (28) به ترمینال بالایی خود (42) متصل است که از سه قسمت ساخته شده است. دو دیسک رسانای فلزی (قرمز، 30 و 32) با عایق (بنفش، 34) در بین آنها وجود دارد.
معمولاً دیسکها لمس میشوند و اجازه میدهند جریان از الکترود به ترمینال آن عبور کند. اما اگر باتری بیش از حد گرم شود و فشار در داخل جمع شود، دیسکها از هم جدا شده و جریان بیشتری را متوقف میکنند. هرگونه گاز اضافی از شکافهای کوچک (زرد، 56) در کنارههای قاب خارج میشود.
مخترع باتری یون لیتیوم کیست؟
بستههای باتری لیتیوم یون در دهه 1970 توسط گودنوف و همکارانش «فیل ویزمن» (Phil Wiseman)، «کوئیچی میزوزیما» (Koichi Mizushima) و «فیل جونز» (Phil Jones) در دانشگاه آکسفورد ارائه شدند. تحقیقات آنها در سال 1980 منتشر شد و توسط شرکت سونی که اولین باتریهای لیتیومی را در اوایل دهه 1990 تولید کرد، به یک فناوری تجاری تبدیل شد. از آن زمان، این باتریها به محصولی عادی تبدیل شدهاند و سالانه در حدود 5 میلیارد باتری تولید میشود (طبق گزارش خبری بلومبرگ در سال 2013) که بیشتر آنها در چین است. سه پیشگام فناوری باتری لیتیومی، یعنی جان گودنوف، «م. استنلی ویتینگام» (M. Stanley Whittingham) و «آکیرا یوشینو» (Akira Yoshino)، جایزه نوبل شیمی سال 2019 را برای کارهای پیشگامانهشان، دریافت کردند. مانند همه دانشمندان، تحقیقات آنها میتواند به اکتشافات قبلی بازگردد. در این مورد، اشاره به گیلبرت لوئیس شیمیدان آمریکایی و تحقیقات او در مورد الکتروشیمیایی لیتیوم، در اوایل قرن بیستم شایان ذکر است.
آینده باتریهای لیتیومی چگونه خواهد بود؟
امروزه، باتریهای لیتیومی مزایایی نسبت به باتریهای نیکل-کادمیوم دارند که در گذشته نداشتند، البته هنوز تا پایان داستان فاصله زیادی است. همانطور که قبلاً گفتیم، مشکلاتی مانند ناپایداری حرارتی وجود دارد که دانشمندان هنوز هم به دنبال حل آن هستند. در همین حال، کند کردن سرعت تغییرات تخریبگر آبوهوایی نیازمند باتریهای ارزانتر، ایمنتر، کممصرف و سازگار با محیط زیست است که سریعتر شارژ شوند و فضای کمتری را اشغال کنند.
همزمان که این جملات را میخوانید، تحقیقات هیجانانگیز زیادی در جریان است. باتریهای گرافن با شارژ سریع، آنهایی که از نانومواد پیشرفته دیگری مانند نانولولههای کربنی ساخته شدهاند و حتی آنهایی که مبتنی بر ویروسها و ویتامین های مهندسی ژنتیکی مانند فلاوین هستند، میتوانند در آینده بسیار نزدیک برق کامپیوتر یا تلفن هوشمند ما را تأمین کنند!

